今回の記事では中和滴定における指示薬の選び方について解説します。
が、その前に簡単に中和滴定とは何か知ってますか?
中和滴定とは?
中和滴定とは
濃度の分からない酸あるいは塩基に対して
濃度の分かっている酸あるいは塩基を加えていって
未知濃度を求めるための実験操作のことです。
この中和滴定という濃度測定のための実験に使われるガラス器具として
・三角フラスコ
・ビュレット
・メスフラスコ
・ホールピペット
などがあります。
中和滴定で利用する指示薬には何がある?
中和滴定で使われる指示薬とは中和点で変色する薬品のことです。
たとえば食酢も水酸化ナトリウムの水溶液も無色透明だから
何mL滴下したって見た目には何も変化しません。
ではどうやって中和点を知ればよいのでしょう?
中和点を知るために入れておく薬品が指示薬です。
・フェノールフタレイン(変色域はpH8.2から9.8)
・メチルオレンジ(変色域は pH 3.1から4.4)
の2つがあります。
ではどっちを使えばよいのでしょう?
これは使っている酸・塩基の強弱で決まります。
その強弱、そして指示薬、どういう基準で選ぶのか?
という話をしていきます。
中和滴定で利用する指示薬の選び方
まず滴定曲線という曲線が指示薬を選ぶための基準になってきます。
ビュレットからの滴下量と溶液のpHの関係をグラフ化したものが滴定曲線といいます。
滴定曲線ですが、まず強塩基を強酸に加えた場合から考えていきましょう。
たとえば塩酸に水酸化ナトリウムを入れるときって
当然最初は強い酸性ですよね。
なので以下のような曲線になります。
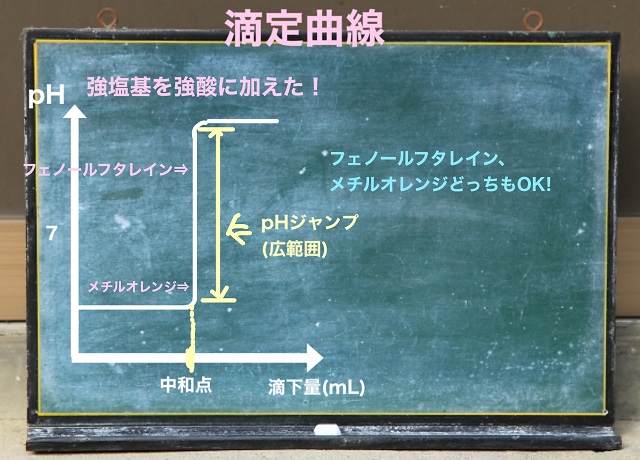
上記のように最初はpHがそんなに大きなりません。
酸が余っている間はいくら塩基を入れても溶液が酸性のままだからです。
なので、いくら強塩基を入れてもいきなりpHが大きくなるわけではありません。
最初はほとんど変化しません。
ただ、塩基を加えていって
酸が完全に中和された。
次の1滴で一気に液性は塩基性に変化します。

つまりpHは中和点で一気に変化するような変動の仕方をします。
pHが大きく変動したところを中和点とみなします。
pHの大きな変動がみられる部分をpHジャンプといいます。
強酸と強塩基の場合、このpHジャンプは広範囲になります。
指示薬というのは中和点で変色すればよいわけです。
だから中和点でのpHの変動の幅の中に
変色域(色が変わる領域)が入っていればよいです。
強酸と強塩基の場合、メチルオレンジもフェノールフタレインも
どちらもpHジャンプ内に入るので両方利用可能です。
フェノールフタレインの変色域はpH8.2から9.8で
メチルオレンジの変色域はpH3.1から4.4の間でしたからね。
pHジャンプ内に変色域があれば指示薬として使えると覚えておきましょう。
続いて弱酸に強塩基を加えたパターンを見ていきましょう。
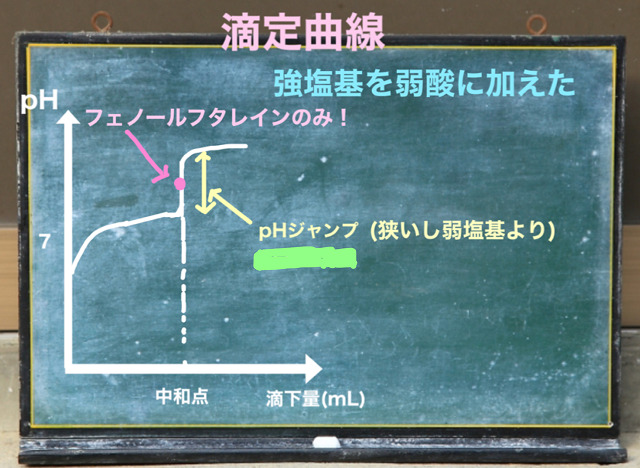
弱い酸に強塩基だと中和点が塩基性になります。
なので、この場合はフェノールフタレインしか指示薬が使えません。
次に弱塩基に強酸を入れた場合、
どうなるでしょう?
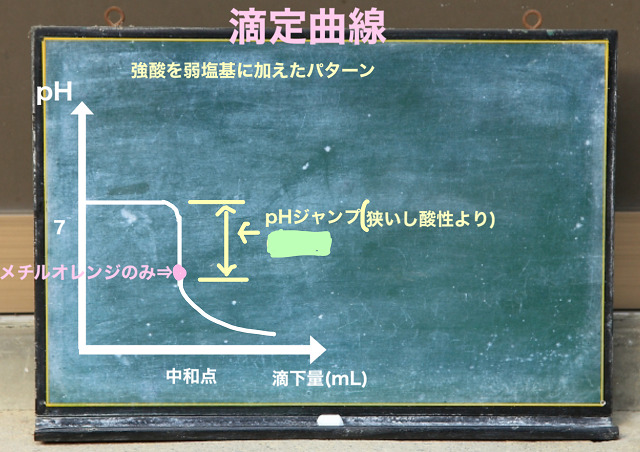
弱塩基に強酸を入れた場合には
中和点は酸性側になります。
なので、pHジャンプは酸性側なので、メチルオレンジのみが
指示薬として使えるということです。
ということで指示薬の選び方についての解説を終わります。















