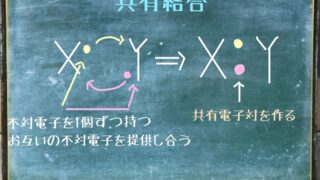「分子量と式量の求め方がよくわからない!」
そんな方に向けて記事を書きました。
ぜひ最後までご覧ください。
分子量と式量の求め方をわかりやすく解説
分子量と式量の違い
原子量は原子1個の重さを表す数値です。
詳しい求め方はこちらで解説しています。
⇒原子量・分子量・式量の違いについてわかりやすく解説
原子量について簡単に説明させていただきますと
人が勝手に決めた原子1個の重さのこと
この程度に捉えておいたらOKです。
厳密にいったら
以前の記事で質量数について解説しましたが
質量数=陽子+中性子の数
ですが、これが陽子と中性子の数の和(=質量数)が原子1個の重さです。
⇒原子量と質量数の違いについてわかりやすく解説
ちなみに陽子は原子番号と等しいです。
たとえば、ヘリウムは原子番号が2で質量数は4です。
なので${}^{ 4 }{}_{ 2 } He $と書き、
原子量は約4となります。
これが重さですが、細かいことをいうと
ここからいろいろあります。
同位体とかいろいろ気を使わないといけないところが。
とはいえ平たく言ってしまえば
原子量というと他人が勝手に決めた
原子1個当たりの重さだというくらいの理解でOKです。
詳しく知りたい方はこちらをご覧ください。
⇒原子量と質量数の違いについてわかりやすく解説
そして人が勝手に決めた原子1個の重さ(=原子量)に
単位はありませんが
たとえば水素原子1個の重さ(=原子量)は1.008です。
ただ、試験問題だとたいてい
原子量は問題文に書いてあります。暗記不要です。
もし問題文に原子量が書いてなかったら
必要ないと逆に捉えてもらっても問題ないと思います。
ただし、原子量はC=12、H=1、O=16とする。
みたいに記載されているはずです。
だから原子量の求め方を覚えるとか数値を暗記するのは後回しで良いです。
先に式量と分子量の求め方を完璧にしましょう。
・O(酸素)の原子量は16
・Na(ナトリウム)の原子量は23
・H(水素)の原子量は1
さらに詳しい解説はこちら
⇒原子量・分子量・式量の違いについてわかりやすく解説
分子量とは?
分子量は分子を作る原子の原子量を全部足したもののことです。
言い換えると分子式として表されている原子量を全部足した合計です。
分子式って例えば水なら$H_2O $ですし
水素なら$H_2 $です。
原子だったら水素は$H $ですからね。
これでも分子式がわからない人はこちらをご覧ください。
⇒構造式・示性式・分子式・組成式の違いを酢酸を例にわかりやすく解説
後でもう1回分子量の求め方について解説しますが
ここでも簡単に解説しますね。
・$H_2O $(水)の分子量は
水素の原子量1で2つあって酸素の原子量が16で1つだから
1×2+16=18
式量とは?
式量とはイオン結合でできている原子の
原子量を全部足したもののことです。
だから別に問題を解くだけだったら分子量=式量という理解でOKです。
だって分子量だって式量だってどちらも
原子量を全部足せば答えになるわけですから。
分子量の求め方と式量の求め方はまったく一緒ってことです。
もちろん厳密に考えたら分子量と式量は違いますけどね。

たとえば食塩はNaCl(エヌエーシーエル)って書きますよね。
イオン結合の特徴ところで解説したように
食塩は上記図のように$Na^{+} $と$Cl^{ー} $が
無限レベルでつながっています。
⇒イオン結合の特徴についてわかりやすく解説
「そんなの分子式で書こうとしたら書ききれないじゃん!」
ってなりますよね。
そこで繰り返しの最小単位で書こうってなるわけですよ。
でないと紙の上に無限にNaとClを書き連ねるわけにはいきませんからね。
上記図よりNaClは$Na^{+} $と$Cl^{ー} $が
繰り返されていることがわかります。
そこで以前解説した組成式で無限に連なるNaとClを表せばよいわけです。
⇒構造式・示性式・分子式・組成式の違いを酢酸を例にわかりやすく解説
$Na^{+} $200、$Cl^{ー} $200みたいに
存在する数で書かずに約分して
$Na^{+} $:$Cl^{ー} $=1:1の比で
くっついているということをシンプルにNaClと表すのが組成式でしたね。
大丈夫でしょうか?

実際のNaClは上記図のようなのが無限に連なっているんです。
でもそれじゃ、表現しきれないので組成式としてNaClと表現しているんです。
こんな感じでイオン結合でできているものは
NaClの例のように無限に連なるために
共有結合の分子式みたいに全体を式で表すことができません。
だからイオン結合でできたものは
組成式で表すことに決まっていると考えてください。
で、求め方は分子式の場合と同じで
組成式でできた構成要素の原子量を足し合わせます。
足し合わせた数字を式量といいます。
だから式量というのはイオン結合でできている化学式の
原子量を足し合わせた数字のことです。
でも試験対策としては
分子量と式量で求め方に差はありません。
ちなみに式量の求め方としては
Naの原子量は23で
Clの原子量は35.5と問題文に書かれているとして
NaClだったら、これはイオン結合なので
式量は23+35.5=58.5
式量は58.5だということがわかります。
分子量と式量の求め方を例題を使って解説
では分子量と式量の求め方について解説します。
先ほども言いましたが式量はイオン結合の場合の数字でしたね。
分子量とは原子量の総和のことです。
式量の求め方は分子量の求め方と一緒です。
説明するよりやった方が早いので早速求め方について解説しますよ。
たとえば、$H_2O $(水)の分子量を求めてみましょう。
ただし、水素の原子量を1、炭素の原子量を12、酸素の原子量を16とします。
くどいようですが、原子量は原子1個の重さのことですからね。
このときの水の重さ(=分子量)は?となったときに、
、$H_2O $はHが2つにOが1つありますね。
水素原子H1個の重さ(=原子量)は1で
酸素原子O1個の重さが16です。
あとはこれは足してあげれば分子量になります。
よって、$H_2O $の分子量は
原子量1の水素が2個あるので1×2で
原子量16の酸素原子が1個あるので16×1なので
$H_2O $の分子量は1×2+1=18
となりますね。
こういう計算はできるようになっておきましょう。
では$CO_2 $の分子量はいくらでしょう?
炭素原子C1個の重さが12、酸素原子O1個の重さが16です。
$CO_2 $ということはCが1個、Oが2個ありますから、
12+16+16=44
$CO_2 $の分子量は44となりますね。
分子量44ということは分子1個あたりの重さを意味します。
そんなに難しく考えないでくださいね。
次に式量の求め方の具体例をお見せします。
$Pb(OH)_2 $(水酸化鉛(II))の式量を求めましょう。
水酸化鉛(II)は電気陰性度が1.7と大きいのでイオン結合です。
電気陰性度がわからない方はこちらをご覧くださいね。
⇒電気陰性度と極性についてわかりやすく解説
⇒高校化学の電気陰性度の覚え方教えます!
とにかく$Pb(OH)_2 $(水酸化鉛(II))はイオン結合なので
ここまで解説してきたように分子量ではなく式量を求めることになります。
Pbが207
Oが16
Hが1
としますと、
$Pb(OH)_2 $の式量は
207+(16+1)×2=207+17×2=207+34=241
よって$Pb(OH)_2 $の式量は241と求めることができました。
以上で分子量と式量の求め方について解説しました。
参考になったようでしたらうれしいです。