今回の記事では高校化学で登場する電気陰性度の覚え方をお教えします。
その前に前提知識となる不対電子から解説しますね。
電気陰性度の覚え方
電子式と不対電子
電子式というのは最外殻電子を元素記号の周りに
できるだけペアを作らないように並べていったものになります。
もう少し具体的に解説しますね。
原子番号が6の炭素について考えてみましょう。
${}_6 C $ですね。
原子番号が6番ですから電子を6個持っています。
これは復習ですよ。
よくわからない場合はこちらをご覧ください。
⇒電子殻の収容数が分からない方はこちら
上記を読んだ後次にこちらを読んでください。
⇒価電子と最外殻電子の違いについてわかりやすく解説
話を元に戻します。
${}_6 C $は
原子番号が6番ですから電子を6個持っています。
なのでK殻は2個で締めきり、はみ出た部分はL殻が引き受けます。
L殻は4個を引き受けます。
なので
K(2)L(4)
となるわけですね。
すると炭素の電子配置、最外殻電子はL(4)になりますよね。
⇒価電子と最外殻電子の違いについてわかりやすく解説
最外殻電子を元素記号の周りに
できるだけペアを作らないように並べていきます。
最外殻電子が4つです。
この最外殻電子を元素記号Cの周りに
できるだけペアを作らないように並べていきます。
最外殻電子は4つなので
以下のようになります。

どこにどれを書いてもかまいません。
ペアを作らないように上記のように〇をつけていきます。
原則は元素記号の上下左右に2個ずつ電子が入るので
最大8個まで〇をつけることができます。
では原子番号が7の窒素(${}_7 N $)はどうなるでしょう?
原子番号が7ですから、陽子も電子も7個あります。
陽子の意味が分からない方はこちらをご覧ください。
⇒原子の構造について図を使ってわかりやすく解説
とにかく窒素は電子が7個ありますから、
K殻は2個で締め切り、はみ出た分はL殻が引き受けます。
だから残りの5個はL殻に行くのでL殻は5個です。
なので最外殻電子は5個です。
K(2)L(5)
となり最外殻電子が5つですから、
電子式は4個目までは炭素と同じ。
5個目はしょうがないのでペアを作ります。

なので上記のようになります。
このように電子を書いていくことを電子式といいます。
詳しくはこちらの記事で解説しています。
⇒電子式書き方の決まりをわかりやすく解説
⇒電子式で点の位置の注意ポイントとは?
そしてこのように電子式を書いていくと
1人ボッチの電子が存在しますよね。
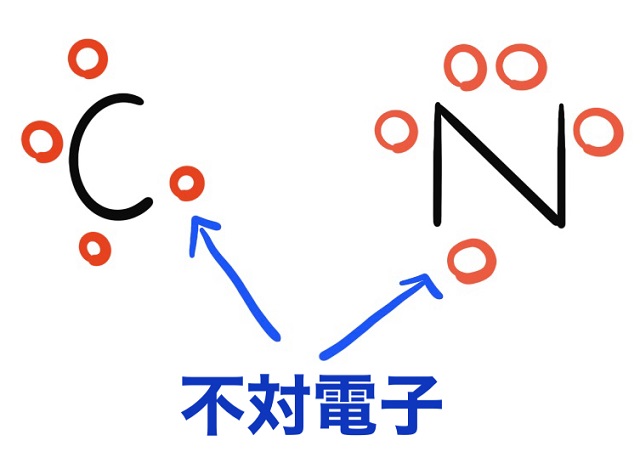
この1人ボッチの電子を不対電子といいます。
対でない、ペアを作っていない電子ということです。
この不対電子(ふついでんし)はペアを作りたくて仕方がありません。
不対電子同士でペアを作りたいのです。
だから不対電子同士でペアを作ってくっつきます。
電気陰性度
ここから少し難しい話になりますが
電気陰性度という話に入っていきます。
少し難しい概念ではありますが
覚え方がわかれば忘れにくくなるのでここからの解説を
じっくりと読んでみてくださいね。
具体的に解説していきますね。
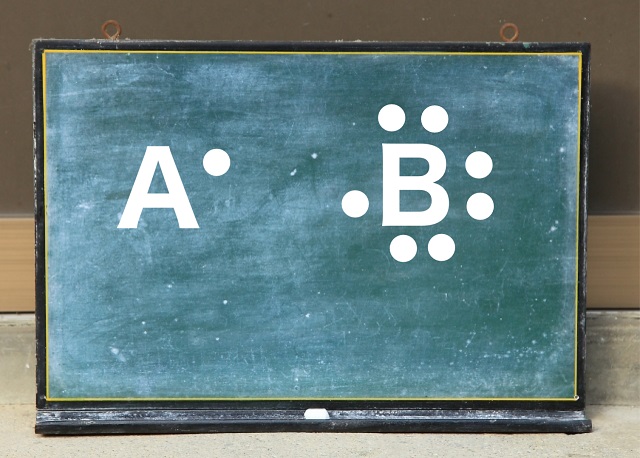
たとえばAという原子が不対電子を持っているとしましょう。
そしてBという原子も不対電子を持っているとしましょう。
するとさっき言ったように不対電子同士はペアを作りたがります。
このことを『結びつく』とか『結合する』といいます。
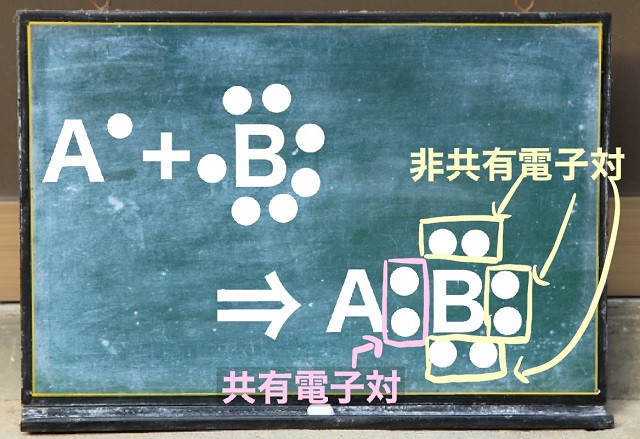
AとBがお互いに不対電子を出しあって
ペアを作りました。
これを結合するといいいます。
するとAとBにお互いに共有されている電子対ということで
共有電子対(きょうゆうでんしつい)と呼びます。
これに対して共有されていない電子対を非共有電子対といいます。
これは用語なのでシンプルに覚えておきましょう。
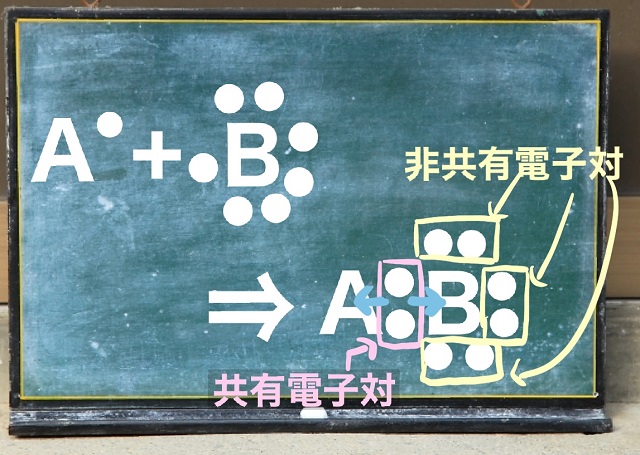
ところで共有電子対をAはBに渡したくありません。
独り占めしたいのです。
逆にBもAに共有電子対を渡したくありません。
お互いに綱引きを始めます。
いちいち綱引きをさせてどっちが勝つとか負けると
実験をするのは大変です。
だから昔の人がこの共有電子対を引っ張る強さを数字にしてくれたのです。
これを電気陰性度といいます。
つまり電気陰性度とは共有電子対を引っ張る強さを数値化したもののことです。
この数値のおおよその結果は覚えておきましょう。
細かい数値の値を覚える必要はありません。
でもおおまかな傾向の覚え方をこれから解説していきますね。
おおまかな電気陰性度の覚え方
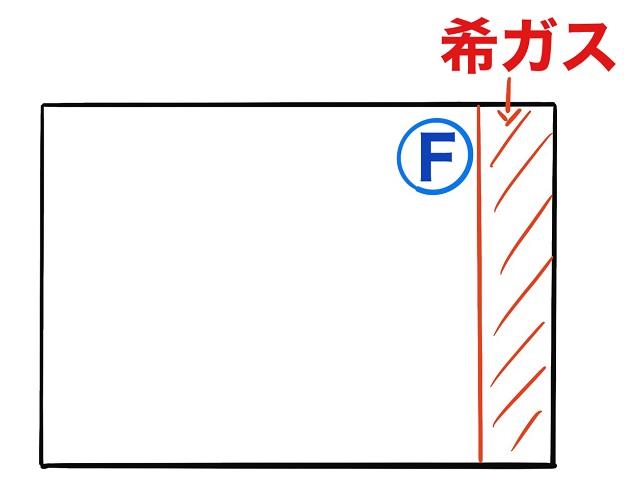
上記図は周期表を簡略化したものです。
一番右側は貴ガス(希ガス)です。
希ガスは他のものとくっつきません。
単原子分子として存在します。
他のものと結合しないということは綱引きする必要もありません。
なので希ガスの電気陰性度はありません。
希ガスについてはこちらの記事で解説しています。
⇒価電子と最外殻電子の違いについてわかりやすく解説
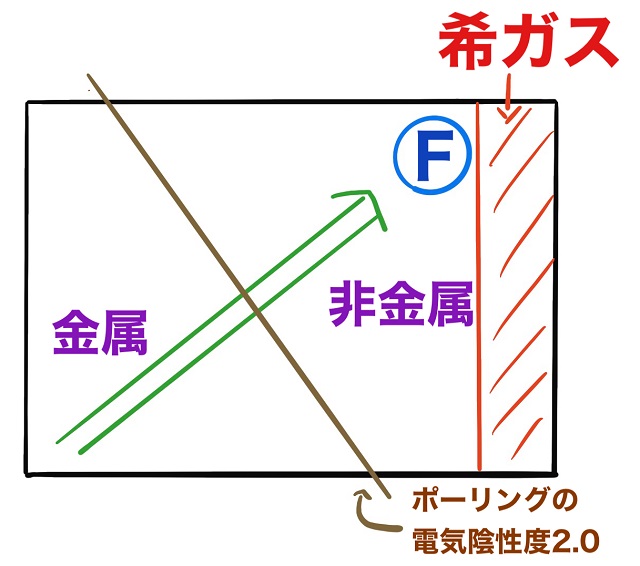
希ガスを除いたものについては周期表で右上に行くほど電気陰性度が大きくなります。
そして希ガスを除いて周期表で一番右上にあるものはF(フッ素)です。
F(フッ素)は電気陰性度がナンバーワンに大きいです。
そしてだいたい金属と非金属の境目をAl(アルミニウム)を通るように線を引きます。
(上記図の茶色線参照)
すると金属は電気陰性度がだいたい小さくて
非金属が電気陰性度がだいたい大きいです。
そしてポーリングさんが電気陰性度を計算してくれていますが
ポーリングの電気陰性度で2.0というのが上記画像のような場所です。
だから目安として2.0を頭に入れておいてほしいです。
なので2.0よりも電気陰性度が小さいものが金属がほとんどで
2.0よりも電気陰性度が大きいものが非金属がほとんどになります。
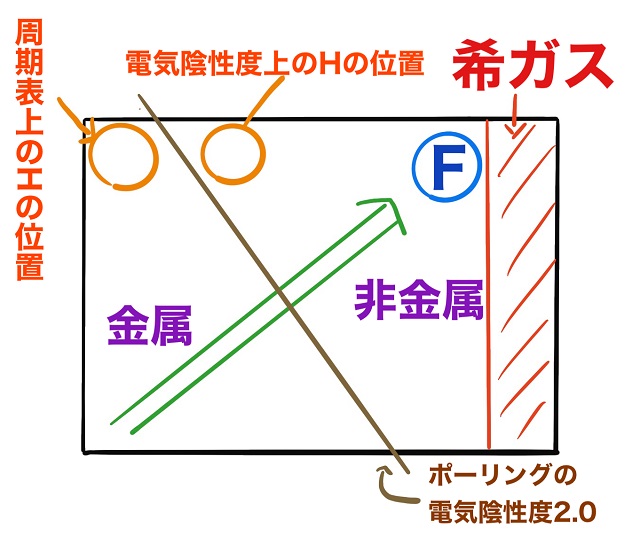
そして水素Hは非金属でした。
周期表では水素は上記図のような場所にありますが
電気陰性度ではちょっと右側に来ます。
電気陰性度で周期表を書くなら水素の位置は上記図のような場所になります。
特に覚えておいてほしいのはフッ素F、酸素O、窒素Nの3つは
特に電気陰性度が大きいという点です。
以上のことを覚えておきましょう。