以前の記事で原子について解説しています。
原子と原子をくっつけてもっと大きくなると
普段私たちが見ている身近なものになっていきます。
以前の記事で原子と原子のくっつきかたについて解説しています。
今回の記事ではそもそもどんなふうに電子の様子を
元素記号に書き込むか?
電子式で点をつける位置で気を付けるポイントについて
解説していきます。
電子式で点をつける位置で気を付けるポイント
電子式は点電子式と書くこともあります。
で、電子式のルールについては別の記事で解説しています。
ここでは簡単に電子式とは何か?説明しておきますと
電子式とは元素記号(例、炭素ならC)の周りに最外殻電子を塗ったもののことです。
そして今回の記事のテーマになるのですが、
電子式で点の位置で注意して欲しいことがあります。
それは『できるだけペアを作らないように塗る』ということです。
ただ、電子式の点の位置は
2つ埋まっている数と不対電子の数が正解なら
どの位置に配置しても問題ありません。
「???」となった方もいると思うので
炭素Cを例に電子式の点を打つ位置について解説しますね。
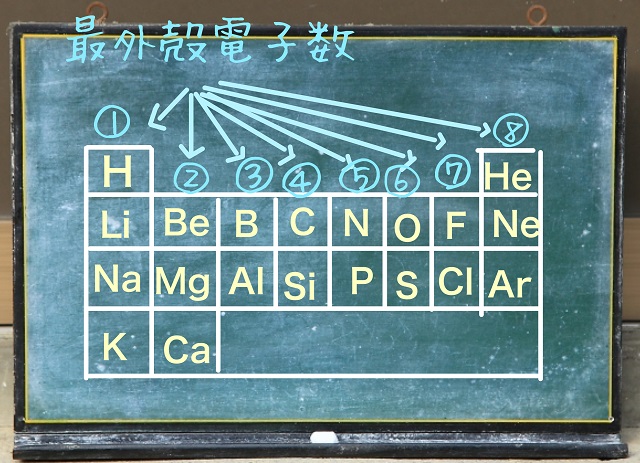
上記周期表をご覧ください。
炭素はH、He、Li、Be、B、Cと数えていくと6番目にあります。
6番目にあるので原子番号は6となります。
原子番号は元素記号の左隅下に書きますので、${}_{ 6 } C $となります。
ちなみにH、He、Li、Be、B、Cという順番は陽子の数です。
陽子の数=原子番号
です。
原子というのはプラスの数とマイナスの数が同じです。
炭素はプラスを6個持っているので
6個のマイナスを持っているということです。
このマイナスを順番にK殻からつめていきます。
K殻は2個しか入りませんでしたね。

Lは8個まで入れられますが、炭素は6個しかありません。
K殻に2個使っているので4個しか入りませんね。
なので上記周期表に書いてある数字のように最外殻電子数は4個となります。
この4個の最外殻電子を元素記号の周りに
『できるだけペアを作らないように』塗っていきます。
このとき『原則として(例外あり)』元素記号の上下左右に2個ずつ
電子を埋めることができますので、
マックス8個まで引き受けることができます。

今回の場合、炭素の最外殻電子は4個です。
できるだけペアを作らないように点を打っていくので上記図のようになります。
これが電子式(点電子式)といいます。

このように点電子式を塗っていくと
ペアになっていない電子がありますね。
というか炭素の場合は全部ペアになっていませんね。
上下左右の点全部が1個ずつだから。
こんな感じでペアになっていない一人ぼっちの電子を
対になっていない電子ということで『不対電子』といいます。
もう少し見ていくことにしましょう。

上記周期表より、窒素原子の最外殻電子は5個ですね。
窒素の原子番号は7で、7個の電子がありますので
K殻が2個、L殻が5個だからです。

この最外殻電子の5個を元素記号の周りにできるだけペアを作らないように
上下左右に塗っていきましょう。
ということで4個までは炭素原子の塗り方と同じです。
5個目は1つだけペアを作る塗り方をしないといけません。
なので上記図のようになります。
ペアになっている部分が電子が対になっているので
『電子対(でんしつい)』といいます。

電子対はくっつくときに共有されない電子対なので
非共有電子対というときもあります。
以上で解説を終わります。














