原子やイオンが結びつくことを化学結合といいますが、
これらがたくさん集まると最後はオキシクリーンなどの固体になります。
このオキシクリーンなどの固体を作るときの化学結合に
何があるのか?以後解説していきます。
・共有結合
・イオン結合
・金属結合
・分子間力など
があります。
こういった化学結合によって粒子が結びついて最後は個体が出来上がります。
今後はこういった結合について説明していきたいのですが、
その前に電子式という表記の仕方を書けるようにならないといけません。
特に共有結合の理解に電子式は必須です。
そこでこの記事では電子式の書き方の決まりについて解説します。
電子式の書き方にどんな決まりがあるの?
共有結合という結合は最外殻電子を使って作る結合です。
「最外殻電子の意味が分からないよ!」という方は
こちらの記事を先にご覧ください。
⇒最外殻電子とイオンの関係をわかりやすく解説
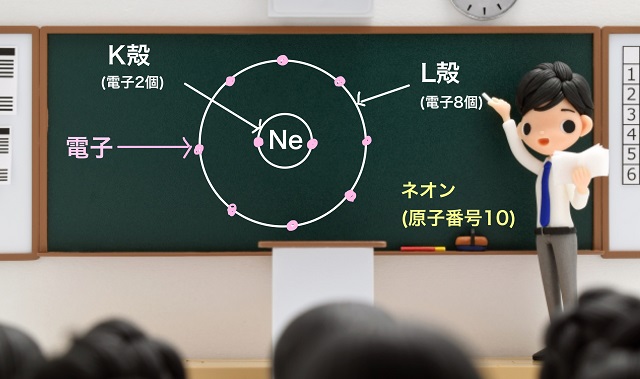
ここでは簡単に最外殻電子とは何か説明しておきますね。
最外殻電子とはもっとも外側の電子殻に存在する電子のことです。
上記画像のNe(ネオン)ならL殻に存在する電子が最外殻電子になります。

最外殻電子がどのような配置になっているかということを
上記画像のように〇とか●を使って表現したものを電子式といいます。
では電子式の書き方の決まりについて説明していきますね。
電子式の書き方決まり(1)
元素記号(CとかNとかLiとか)の周りに最外殻電子の数だけ●や〇を打っていきます。
大学受験などでは〇より●(黒ぽち)の方が一般的です。
最外殻電子の数の分だけポンポンと●や〇を打っていきます。
電子式の書き方決まり(2)
最外殻電子の数だけ●を打ちますが、
●を打つ時は元素記号の周囲4方向に1個ずつ打ちます。
たとえば炭素なら元素記号Cですが、
上下左右に4方向に1個ずつバランスよく●打っていくという決まりがあります。
この決まりにのっとって有名な原子の電子式を考えていきましょう。
まず水素原子の電子式からいきましょう。
まず水素原子の原子番号が1番ですから陽子の数は1個ですし
電子の数も陽子の数と一緒だから1個です。
ここの意味が分からない方はこちらをご覧ください。
⇒原子の構造について図を使ってわかりやすく解説
水素原子の最外殻電子はK殻に1個だけですね。
ここの意味が分からない方はこちらをご覧ください。
⇒電子殻の収容数が分からない方はこちら
電子式の書き方の決まりから、水素原子の電子式は

となります。
上記電子式ではピンク色の●で示していますが、
普段の学習では鉛筆やシャープペンシルで黒い色の●で打つようにお願いします。
他にも炭素原子(C)を例に電子式を作ってみましょう。
Cは原子番号が6番目です。
なので、陽子数や電子数は6つです。
K殻に2個電子が入って残り4つの電子はL殻に入っています。
なので最外殻電子数は4個ですから4つの黒ぽちを書きましょう。
ですから、炭素原子の電子式は決まりから
上下左右に1個ずつ黒ぽちを打てばよいですね。
バランスよく打っていきましょう。
でないと電子式として成立しません。

上記図が炭素原子の電子式となります。
こんな感じで最外殻電子の数だけ●の形でバランスよく周囲に1個ずつ打っていけばよいです。
では酸素原子の電子式はどうなるでしょうか?
O原子です。
酸素原子の原子番号は8番になります。
K殻に2つ、L殻に6つ、これが酸素原子の電子配置になります。
まず電子式のルールから元素記号の周囲に1つずつ●を打っていけばよいですね。
まず周囲に1個ずつ合計4個●を打っていきましょう。

あと、もう2個●を打っていかないといけませんね。
酸素原子の最外殻電子数は6個ですからね。
6個-すでに打った4個=残り2個
ですからね。
どこか2方向は電子を2個ペアになるように●を書いていきます。

これで酸素原子の電子式になりますね。
今、左右を2つにしましたが、別に上と下でもいいです。
2つペアにする場所はどこでもいいです。
残り2つがペアになってない形で表現すればよいです。
ただ、上記図のようにバランスよく上下とか左右をペアにすることが多いです。
以上、有名な原子の電子式を例に書いてみました。
この電子式を書いたときに出てくる電子には名前がついています。
上記酸素原子、ペアになっているものとなっていないものがありますね。
ペアになっているものとなっていないもので名前が分かれています。
まず水素原子を見てください。

ペアになっていない電子が1個ついていますね。

炭素原子にもペアになっていない電子が4個ついていますね。
酸素原子はペアになっていない原子が2つありますね。

ペアになっていない、言い方を変えるとシングルの状態で存在する電子を不対電子といいます。

電子というのは2個ペアになってもっとも安定化します。
不対電子(ふついでんし)は1個だけなので落ち着かない、不安定な状態です。
これに対して、
2つペアになっている電子もありますね。
このペアになっている電子は電子対(でんしつい)といいます。

特に電子対はその原子が単独で所有している電子対です。
他の原子と関わってできる電子対ではありません。
もともと自分の最外殻電子で作った電子対です。
こういうのを他の原子と共有していないという意味で非共有電子対(ひきょうゆうでんしつい)といいます。
非共有電子対はペアになっている状態なので、
非常に安定な状態です。
ここから生まれるのが共有結合です。
次回の記事では共有結合について解説します。
⇒共有結合とは?簡単に例を挙げながら解説します














