前回の記事では電子殻に入る収容数について解説しました。
⇒電子殻の収容数が分からない方はこちら
K殻に2個電子が入ったら次にL殻に8個入って・・・
みたいな話でしたね。
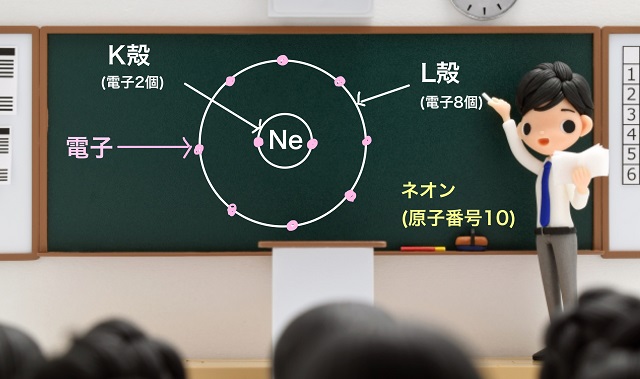
たとえば、Ne(ネオン)だったら原子番号が10なので、
K殻に2個、L殻に8個電子が入っています。
実はこのネオン(Ne)ちょっと特殊です。
他にもHe(ヘリウム、原子番号2)も特殊です。
以下の図はヘリウムです。
何が特殊かというと、K殻は最大2つまで電子が入りますが
Heの場合、ちょうど2つ入っています。
つまりギリギリまで満タンに入っているという表現になります。
ちなみに以前解説したように
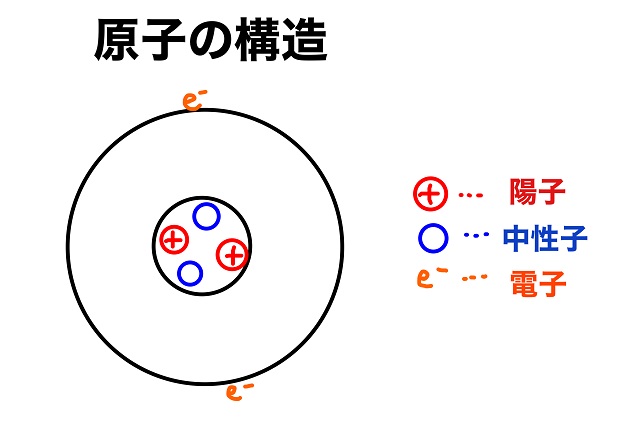
陽子数=原子番号=電子数
でしたね。
⇒原子の構造について図を使ってわかりやすく解説
Heは原子番号が2だから電子数も2個です。
次にNeをご覧ください。

前回の記事で解説しましたがL殻は最大で8個まで入れることができましたね。
⇒電子殻の収容数が分からない方はこちら
Neの場合、L殻に最大である8個の電子が入っていますね。
今、解説したHe(ヘリウム)とNe(ネオン)ですが、
満タン状態です。
ところで、一番外側の電子殻を最外殻といいますが、
NeもHeも最外殻が満タンの状態です。
また、最外殻にある電子を最外殻電子といいます。
ここで
原子は最外殻が電子で満たされたものになりたがっている!
この重要な事実を知っておいてください。
原子はなんとかして満タンになりたいのです。
そうなるためにどうすればよいのか?
という話をしていきます。
最外殻電子とイオンの関係
まず塩素を例に見ていきましょう。
塩素は原子番号が17です。
なので電子数は17個となります。
K殻に2個、L殻に8個、M殻に7個電子が収容されます。
で、原子は満タンになりたいと先ほどいいました。
ちょっとややこしい話になりますので、結論だけ覚えておいて欲しいのですが、
K殻は2個で満タンになり、それ以降(L殻とかM殻、N殻など)は8個で満タンになります。
「8個で満タン?M殻は18個で満タンになるんじゃないの?」
と思った方もいるでしょう。
でも8個で満タンです。
M殻などが8個で満タンになる理由は大学の化学レベルなので
ここでは割愛します。
結論だけ知っておいていただければ幸いです。
ここまで前提にすると、塩素原子は原子番号が17です。
K殻が2個、L殻が8個、M殻が7個なので、
あと1個M殻に電子が入れば塩素原子は喜びます。
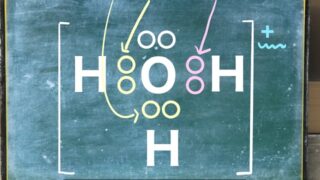
以下の図はClで最外殻電子が7個を表しています。

ピンクの丸は最外殻電子に存在する電子です。
こういう図を電子式といいます。
電子式は最外殻電子のことを指しています。
で、塩素の場合、あと1個電子が入ってきたら満タンになって安定します。
次にNa(ナトリウム原子)をご覧ください。
Naは原子番号が11なので電子の数は11個です。
K殻に2個、L殻に8個、L殻に1個電子が入るので
最外殻(L殻)は以下の左側のようになりますね。

原子というのは最外殻電子の配置を電子ですべて満たしたいと思っています。
まず、塩素から見ていきましょう。

塩素の場合、最外殻電子を満タンにするためにある1つの方法をとりました。
外部にあった電子を自分の最外殻に取り込む(受け取る)という方法です。
すると右側のように塩素の最外殻が8個で満タンになりました。
こうなると電気的にバランスが悪くなりますね。
塩素というのは、原子番号が17です。
ということは陽子(プラスの電気)が17個で電子(マイナスの電気)も17個。
なので、プラスとマイナスの電気が同じ数だけあるので、電気的にはプラスマイナス0の状態です。
ところが外から電子を1個もらってきたわけです。
となると、プラスの陽子が17個だけど、マイナスの電子が18個(17+1)になりますね。
差し引き、マイナスの電子が1個だけ多くなりました。
結果、塩素は電気的な性質を持ってしまいました。
このような電気的な性質のことをイオンといいます。
そしてこのときの塩素を$Cl^{-} $(シーエルマイナスと読みます)と書きます。
マイナスの電気が1個分多くなったという意味です。
このようなものをイオンといいます。
より具体的にいうと、Clの場合は1個分マイナスが多いので
『1価の陰イオン』といいます。
これをイオン化といいます。
電気的なバランスが崩れてまででも
最外殻を満タンにしたいということで起こる現象がイオン化です。
次にナトリウムを見ていきましょう。
ナトリウムは原子番号が11なので、電子が11個あります。
K殻に2個、L殻に8個、M殻に1個電子が入ります。
なので、最外殻電子の状態は以下のようになります。

塩素では電子は外から電子を貰ってきて満タンにしました。

塩素の場合、最外殻が7個であってあと1個で満タンだったから1個もらってきました。

でもナトリウム原子は最外殻電子が1個なので
あと7個(満タンの8から1を引いて7)電子を貰わないと最外殻のM殻は満タンになりませんね。
大変ですね。
ここでナトリウム原子は7個を取り込むのは大変だから
最外殻電子の1個を追い出します。
最外殻電子の1個を追い出すと、一番外側にあったM殻の電子た0個になったけど、
内側のL殻の8個が登場し、しかもL殻は8個で満タンなので満たされました。
すると、Naの場合、原子番号が11なのでプラスの電気(陽子)が11個で
マイナスの電気が11個だったけど、1個追い出したから10個になったので、
1個分プラスの電気が多いですね。
プラスの電気が11個でマイナスの電気が10個だから。
したがって$Na $が$Na^{+} $となります。
これを1価の陽イオンといいます。
これもイオン化です。
以上で最外殻電子とイオン(化)の関係についての解説を終わります。