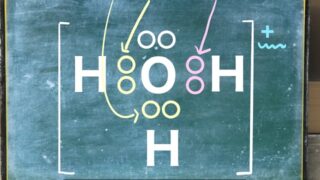
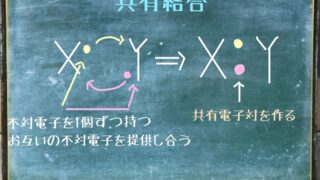今回の記事ではル・シャトリエの平衡移動の法則についてわかりやすく解説します。
Contents
ルシャトリエの平衡移動の法則についてわかりやすく解説
フランス語を習ったことがありますか?
ル・シャトリエの(平衡移動の)法則の『ル』は男性の定冠詞です。
だからル・シャトリエといったら『シャトリエおじさん』という意味になります。
フランス語で『ラ』は女性の定冠詞なので、
もし『ラ』シャトリエだったら『シャトリエおばさん』だったわけですね。
まぁ、どうでもいい話ですが(苦笑)。
フランス語の定冠詞(英語のthe)
男性名詞単数形はle(ル)
女性名詞単数形はla(ラ)
なのでLe Lectierはレ・ルクチエではなくル・レクチエあとラ・フランスは和製仏語 pic.twitter.com/maNmiQNxsE
— ccsdt (@ogw_15kg) December 12, 2020
では本題に入っていきますよ。
まぁ、ルシャトリエの平衡移動の法則の『平衡』ってどういう意味でしょう?
平衡とはわかりやすくいうと『止まっている状態』のことです。
化学平衡の状態では,反応が止まっているように見えるだけで,正反応も逆反応も進行しており,両者の速さが同じなんだよ.
— 野島高彦(化学・化学実験・化学要習・大学基礎演習) (@TakahikoNojima) July 30, 2020
ということは『平衡移動』って不思議な言葉ですよね。
平衡という止まっている状態なのに『移動』するわけですからね。
平衡というのはとりあえず止まっている状態です。
ただ圧力を変えたり、温度を上げることで
以下のような反応式でも、右辺に反応が移動したり
左辺に移動したりするわけです。
(可逆反応)
そして最終的には新しいところで落ち着きます。
これを『平衡移動』といっているわけです。
あくまで平衡状態は見かけ上止まっているわけです。
でも、温度を上げるなど、条件を変えたら
現在地点では釣り合いが取れなくなります。
もっと別のところに移動して釣り合おうとします。
条件を変えた場合に、左右どっちに移動して新しいところに落ち着くのか?という話が平衡移動です。
ここまでの話についてはこちらの記事で詳しく解説しています。
・化学平衡についてわかりやすく解説
ところでル・シャトリエの平衡移動の法則は4つあります。
以下、詳しく解説していきますね。
ルシャトリエの(平衡移動の)法則(1)圧力
以下の式をご覧ください。
左辺はいくつありますか?係数に注目してくださいね。
$N_2 $の1つと3H_2 $の3つで合計4つ(4分子)ありますね。
同様に右辺は$2NH_3 $の2分子ありますね。
では圧力を高くしましょう。
圧力を高くすると分子数の少ない方に移動します。
左辺は分子数が4で右辺は分子数が2なので、圧力を高くすると右側に移動します。
これは暗記すべき事項でしょうか?
暗記は不要です。
ルシャトリエの基本理念は『和』です。
『和』とは『和らげること』です。
では圧力を高くした結果、分子数が少ない方に移動することが
『和らげる』ことにつながるのでしょう?
圧力が上がると
圧力が上がりすぎないように分子数を減らすわけです。
圧力を和らげるようにしているってことです。
ルシャトリエの(平衡移動の)法則(2)濃度
という反応について考えてみましょう。
上記反応に、さらに$N_2 $(窒素)を加えてみましょう。
すると、左辺の$N_2 $が過剰に増えます。
なので、$N_2 $を減らそうと右側に移動します。
では上記式に対して$NH_3 $を取り除いたらどうなるでしょう?
つまり、右辺の$2NH_3 $がなくなるわけですね。
すると、平衡は右に移動しますね。
右に移動することで$2NH_3 $の数が元に戻りますから。
ここまでまとめると、
・$N_2 $を加えた
・$NH_3 $を取り除いた
ということです。
・何かを加えたら、その加えたものを減らす方向に平衡は移動する
・減ってしまったら、補う方向に平衡は移動する
先ほどのルシャトリエの理念である『和(和らげること)』で考えてみますと
$N_2 $を加えて増えたら、減らして過剰な数を和らげる方向に
$NH_3 $を取り除いた、数を補ってあげて、できるだけ和らげる方向に反応が進みます。
ルシャトリエの(平衡移動の)法則(3)温度
以下の熱化学方程式があったとしましょう。
上記式があった時に温度を高くしたら左か右、どちらに反応が進むでしょうか?
熱化学方程式については以下の記事で解説しています。
・熱化学方程式の書き方(ルール)をわかりやすく解説
・燃焼熱と生成熱の違いを熱化学方程式を使いながらわかりやすく解説
・熱化学方程式を裏技で圧倒的に簡単に解く方法をコッソリ紹介!
・熱化学方程式における燃焼熱とは?求め方についてもわかりやすく解説
・結合エネルギーの求め方【熱化学方程式】
・ヘスの法則についてわかりやすく解説
・水の蒸発熱44kJ/molがプラスかマイナスか間違えずに熱化学方程式で表す考え方
エネルギー図で考えてみましょう。
エネルギー図については以下の記事で詳しく解説しています。
・熱化学方程式とエネルギー図で発熱と吸熱反応を表すコツ
右辺の92KJを足したら左辺とイコールとなるわけなので、
以下のようなエネルギー図になりますね。
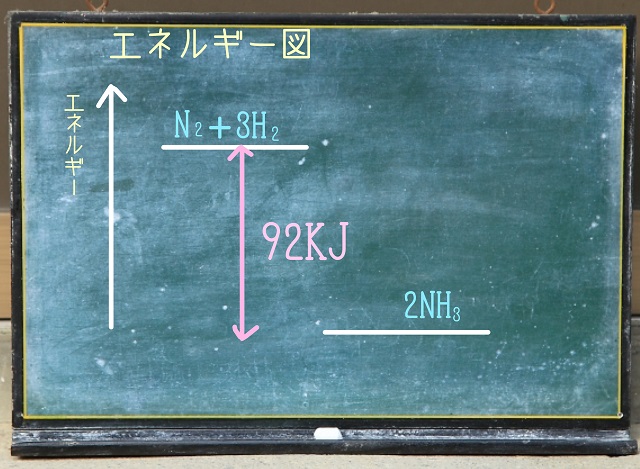
右辺に92KJを足したら左辺とイコールという図です。
だから右辺の方がエネルギー図的には低くなります。
ここで温度を高くしてみましょう。
温度を高くするとエネルギーは上がります。
暑い空気って上に行きますよね。
氷に熱を加えたら液体になり、
液体に熱を加えたら蒸気になりますよね。
氷よりも水の方が、水よりも上記の方がより遠くに移動できますよね。
簡単にいうと、熱を加えた結果、エネルギーが増したからです。
沸騰した液体を手に当てたら火傷しますよね。
これもエネルギーの影響です。
話を元に戻します。
温度を高くするということは、エネルギーが高くなります。
温度を高くすることはエネルギーを加えることと同じです。
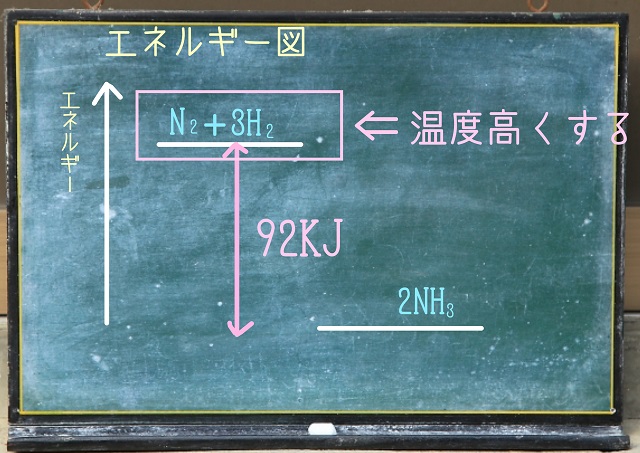
だからエネルギーレベルが高い左辺($N_2 $+3H_2 $)の方が増えます。
逆に冷やすとどうなるでしょう?
冷やすということは熱量を奪う、つまりエネルギーを奪うわけですから、
エネルギーが低くなります。
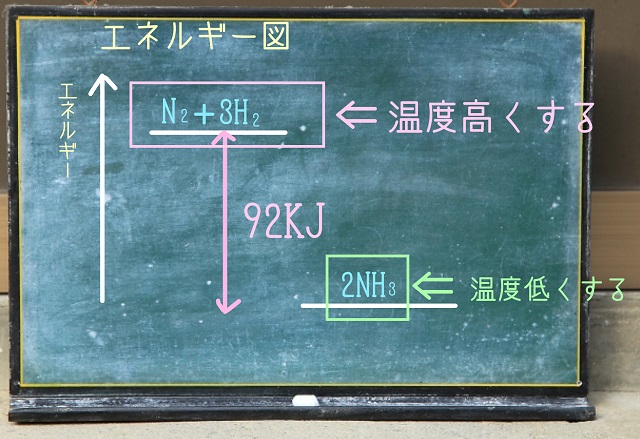
なので、エネルギーの低い方が増えることになります。
別の言い方をすると、温度が高くなると発熱反応は左側に移動します。
で、+92KJとなっているのは発熱反応です。
だから、上記熱化学方程式だと温度を高くすると左側に移動します。
逆に冷やしたら右側に移動します。
逆に吸熱反応は左と右の関係が逆になります。
だから右辺の方が高くなります。
だから、吸熱反応だと温度を上げると右側に進みます。
発熱反応、吸熱反応についてはこちらの記事で詳しく解説しています。
・熱化学方程式とエネルギー図で発熱と吸熱反応を表すコツ
でも、このように考えると小難しいです。

なので、エネルギー図で考えましょう。
温めたらエネルギーが上がる、冷やしたらエネルギーが下がるということを
エネルギー図を使って上下どちらになるか考えましょう。
次に左右を考えます。
温度が高くなれば、上記図だと左に行き、
温度が低くなれば右に行くと理解してください。
そう考えた方が分かりやすいと思いますよ。
ルシャトリエの(平衡移動の)法則(4)触媒
触媒を加えても平衡は移動しません。
触媒についてはこちらで詳しく解説しています。
・化学平衡についてわかりやすく解説
$v_1 $、$v_2 $ともに増加します。
前回の記事で解説しましたが
反応速度は$v_1 $、$v_2 $ともに同じ割合で上がります。
だから、結果的に触媒の場合には平衡移動は起こりません。
どっちも速度が上がるからです。
反応速度についてはこちらの記事で詳しく解説しています。
・化学平衡についてわかりやすく解説
ちなみに触媒と書いてますが、正触媒の話です。
触媒というと反応をアシストするというイメージが強いかもしれませんね。
ルシャトリエの(平衡移動の)法則(番外編)正触媒と負触媒について
反応をアシストする物質のことを正触媒といいます。
今回の記事では正触媒の話でした。
でも逆もあります。
負触媒といいます。
負触媒とは反応を邪魔する触媒のことです。
たとえば、白金カイロ。
白金カイロのおかげでゆっくり燃えるため
火傷せず、燃料も長く持ちます。
白金という負触媒がないと、一気に燃えてしまい火傷するし
すぐに燃え終わってしまいます。
でも白金が反応の邪魔をすることで反応を遅らせ、
結果的にゆっくり燃えるカイロが完成するわけですね。
そんな場合に、負触媒が実生活に役に立つわけですね。
寒さ厳しいので
白金カイロ稼働(・∀・)#白金カイロ pic.twitter.com/x1bbilBIGp— なめたろう (@13_zarusoba) January 8, 2022
触媒というのは反応を助けるだけではダメってことです。
邪魔する触媒も必要ってことです。
以上で解説を終わります。