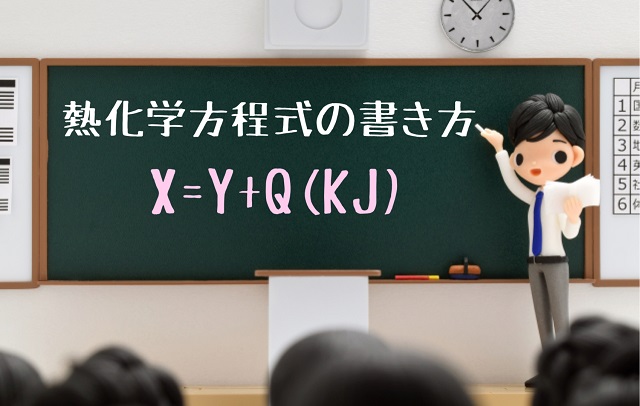前回の記事ではエネルギー図と熱化学方程式を使って
吸熱反応と発熱反応の違いについて解説しました。
⇒熱化学方程式とエネルギー図で発熱と吸熱反応を表すコツ
熱化学方程式というのはちょっとしたうるさいルールがあります。
うるさいといっても従わないと受験に合格できません。
なので、小うるさい熱化学方程式の書き方について
わかりやすく解説していきたいと思います。
熱化学方程式の書き方(1)
それでは熱化学方程式の書き方について解説していきます。
熱化学方程式を書くためのルールは3つあります。
1つ目のルールはまず、
左辺と右辺は矢印(⇒)でなくてイコール(=)でつなぎます。
たとえば、
X=Y+Q(KJ)
みたいに表現します。
よくわからないという方は前回の記事で詳しく解説していますので
先にこちらをご覧ください。
⇒熱化学方程式とエネルギー図で発熱と吸熱反応を表すコツ
熱化学方程式の書き方(2)
2つ目のルールですが、
ちょっと面倒くさい話になります。
状態とか同素体の種類を化学式の後ろに()で表現します。
たとえば、水。
水は$H_2O $で表されますね。
ただ、この$H_2O $が固体なのか液体なのか、気体なのかわからないと
固体と液体と気体で持っているエネルギーが違うわけです。
すると、発熱量も吸熱量も変わってきますね。
固体なのか液体なのか気体なのかによって反応熱が変わるので
・固体なら$H_2O $(固)
・液体なら$H_2O $(液)
・気体なら$H_2O $(気)
といった感じで状態を明記しないといけないというルールになっています。
特に水は常温であっても液体だったり気体だったりしますからね。
また、通常の条件下だと100℃以上に加熱したら気体になりますし、
0℃以下になったら固体にもできますから、
簡単に固体、液体、気体の状態を作ることができます。
なのでどこの状態を表しているのか、きちんと明記しておくというルールになっています。
ただ、熱化学方程式を書くときに水の状態で
何も書いていないケースがあります。
この場合、特に指示がない場合には液体と考えます。
つまり何の指示もない場合、$H_2O $(液)と理解して問題ないということです。
ちなみにNG例を挙げておきますね。
$H_2O $(水)はダメですよ。
これは状態名(固体とか液体)ではなくて物質名(水)になっていますから
熱化学方程式においてはダメです。
$CO_2 $(二酸化炭素)と書くようなものです。
ここまでまとめますと、
(1)左辺と右辺は矢印(⇒)でなくてイコール(=)でつなぐ
(2)状態とか同素体の種類を化学式の後ろに()で表現
でした。
ということで、同素体の種類を化学式の後ろに()で表現の説明がまだでしたね。
一番よくあるのが炭素ですね。
ちなみ同素体についてよくわからない場合には先にこちらの記事をご覧ください。
⇒同素体の具体例
⇒同素体とは?わかりやすく解説
ここで炭素をC(固)って書いてしまった場合、
炭素の固体だということはわかります。
でも、これがダイヤモンドなのか黒鉛なのかわかりません。
ダイヤモンドにしても黒鉛にしても通常の温度では固体ですね。
どっちなのかC(固)だとわかりません。
ダイヤモンドと黒鉛で持っているエネルギーは変わってきますから
反応熱も変わって決ます。
なので固体だけではダメです。
同素体が存在する単体の場合は、これが黒鉛なのかダイヤモンドなのか
きちんと明記するというルールになっています。
・C(黒鉛)
・C(ダイヤモンド)
みたいに書きます。
炭素の単体について特に指示がない場合は黒鉛でOKです。
普通に考えたら黒鉛の方がダイヤモンドよりもありふれているので
黒鉛と考えます。
まさかダイヤモンドを使って燃焼実験をするとかしませんよね。
もったいないですから。
ただ、ルールとしては黒鉛なら黒鉛と書かないといけません。
こんな感じで状態とか同素体の種類が分かるように
化学式の後ろの()内に示すというルールがあります。
熱化学方程式の書き方(3)
では3つ目のルールを追加しますね。
結構大事ですよ。
・熱化学方程式の係数はmol(モル)を使うこと
です。
係数がモル数(mol数)を示すとはどういうことなのでしょう?
たとえば、
$H_2 $(気)+$Cl_2 $(気)=$2HCl $(気)+184kJ
という熱化学方程式があります。
これって日本語に和訳した時に
どのように訳せるでしょう?
通常の化学反応式って係数って比をとるために使います。
$H_2 $(気)+$Cl_2 $(気)=$2HCl $(気)+184kJ
ならば、1:1というモル比で反応してみたいな感じで
係数比という比率をとるためにモルを利用します。
ですが、熱化学方程式で係数比=モル比という考え方を適用すると
おかしな話になります。
たとえば、
$H_2 $(気)+$Cl_2 $(気)=$2HCl $(気)+184kJ
だったら、1:1:2の比率で反応して184kJ発熱するという風に
日本語に直したとしましょう。
すると$H_2 $(気)が100モル、$Cl_2 $(気)が100モル、
$2HCl $(気)が200モルであっても184KJ発熱することになってしまいますね。
これだって比率で考えたら1:1:2ですからね。
1:1:2だったらどんなモル数でも184KJ発熱するのでしょうか?
それって変ですよね。
184KJの発熱があるときってどういうときでしょう?
$H_2 $(気)1モルと$Cl_2 $(気)1モルが反応して$HCl $(気)が2モルできるときに
184KJ発熱するって言っているわけです。
そのままの物質量が反応した時の発熱量が右側に書かれているわけです。
$H_2 $(気)+$Cl_2 $(気)=$2HCl $(気)+184kJ
を日本語に変換してみましょう。
「水素1molと塩素1molが反応し気体の塩化水素が2molできるときに
184kJ発熱する」ということを意味する熱化学方程式です。
こんな感じで比をとるのではなくて
そのままの係数の物質量、そのモル数が反応したときの反応熱が右側に書いてあるわけです。
発熱量だったり吸熱量だったりしますが。
$H_2 $(気)+$Cl_2 $(気)=$2HCl $(気)+184kJ
で、水素1モルが塩素1モルと反応したという解釈になりますが、
ここで、もし水素$\frac{1}{2} $モルが反応したらどうなるでしょう?
全体を2で割ります。
$\frac{1}{2} $$H_2 $(気)+$\frac{1}{2} $$Cl_2 $(気)=$HCl $(気)+92kJ
という熱化学方程式になります。
これを日本語にした時の意味は少し変わりますね。
「水素$\frac{1}{2} $モルと塩素$\frac{1}{2} $モルが反応し気体の塩化水素が1モルできるとき、
92KJ発熱する」という式になりますね。
ここまでまとめますと、
(1)左辺と右辺は矢印(⇒)でなくてイコール(=)でつなぐ
(2)状態とか同素体の種類を化学式の後ろに()で表現
(3)熱化学方程式の係数はmol(モル)を使うこと
です。
熱化学方程式において係数に分数を使うことは認められています。
$\frac{1}{2} $$H_2 $(気)+$\frac{1}{2} $$Cl_2 $(気)=$HCl $(気)+92kJ
みたいに、水素が$\frac{1}{2} $モル反応する時って言いたければ、水素の係数は$\frac{1}{2} $モルにしないといけません。
もし1モルにしてしまったら水素が1モルが反応するときっていう意味になってしまいます。
水素が$\frac{1}{2} $モルが反応する時であれば、
必然的に塩素も$\frac{1}{2} $になるのは構いません。
分数を係数に使われることは認められています。
化学反応式では分数はNGです。
分数が出ないように掛け算をします。
でも、熱化学方程式においては分数の係数を使うことは認められています。
だから何かを1モルという風に固定したい場合、
その物質1モルの反応熱を表したい場合は
その物質の係数を1にして熱化学方程式を作ります。
そのために他の係数が分数になっても構わないというルールがあります。
化学反応式とちょっと違うのは比率ではなくて
係数がそのままモルを表すということを理解しておきましょう。
以上で熱化学方程式の書き方についての解説を終わります。