今回はベンゼンの構造式の謎を解決していきます。
あわせてベンゼンのケクレ構造とか非局在化についても解説していきます。
ベンゼンの構造式ができるまで
ファラデーが発見したベンゼンについて
ベンゼンは有機化学の歴史の中でも論争を巻き起こしたものの1つです。
イギリスのファラデーという人が
街灯に利用されていた鯨油(クジラの油)から
怪しげな物質を発見したところから始まります。
ベンゼンの歴史
1825年、ファラデーによって、鯨油を熱分解したときの生成物の中から初めて発見された。
1833年、ミチェルリヒが安息香酸(benzoic acid)と生石灰を蒸留して得た物質にbenzinと名付けたのが名前の由来となった。(Wikipediaより)
— ベンゼンおじさんの館 【公式】 (@benzene_man) February 13, 2023
ファラデーさんはその怪しげな物質について組成を調べました。
するとその怪しげな物質はC(炭素)とH(水素)だけからできていました。
しかもCとHの比は1対1でした。
こんな感じで不変な組成であることにファラデーさんは気づいたのです。
次にファラデーさんは燃やしてみました。
炭素Cに対して水素Hがあまりにも少ないので
ススを出して燃えました。
たとえば$CH_4 $(メタン)だと炭素Cに対して水素Hが4個といっぱいありますから、
完全に燃焼していきます。
CH₄+2O₂→CO₂+2H₂O
と、メタンを燃焼すると完全燃焼して
二酸化炭素と水になってくれるからです。
これに対して炭素に対して水素があまりに少ないと
不完全燃焼を起こしてススを出して燃えるのです。
炭素原子数と水素原子数が近い化合物(アセチレン、ベンゼン、スチレン、ポリスチレンなど)は燃焼に際して多くのススを発生します。覚えておいて下さいねヾ(@⌒ー⌒@)ノ。
— 照井俊 (@teruishun) January 16, 2013
・完全燃焼は$CO_2 $(二酸化炭素)ができる
・不完全燃焼は$CO $(一酸化炭素)とススができる
です。
炭素や炭素化合物が完全燃焼すると[ 二酸化炭素CO₂ ]が生じる。
★C + O₂ → CO₂
★完全燃焼はCO₂、不完全燃焼はCOが生じます。— 高校化学 無機化学bot 大学受験 大学入試アプリ (@kagaku_m_test) February 12, 2023
では反応性はどうでしょう?
ベンゼンは炭素に対して水素は少ないのに
非常に安定していました。
分子量を調べて分子式を調べてみたところ
$C_6H_6 $でした。
$C_6H_6 $という不思議な構造だったので
いろんな研究者がいろんな研究結果を報告しました。
ある人は炭素Cが6個つながっていて
ところどころで二重結合とか三重結合がるんじゃないか?
みたいに考えました。
またある研究者は輪っかが4つくっついたような立体的で不思議な
構造を考えたりしました。
こんな感じでいろんな研究者がいろんなベンゼンの構造を発表しました。
ただいろいろ反応させてみても
研究者が主張する構造というのはイマイチでした。
ケクレが提唱したベンゼンの構造とは?
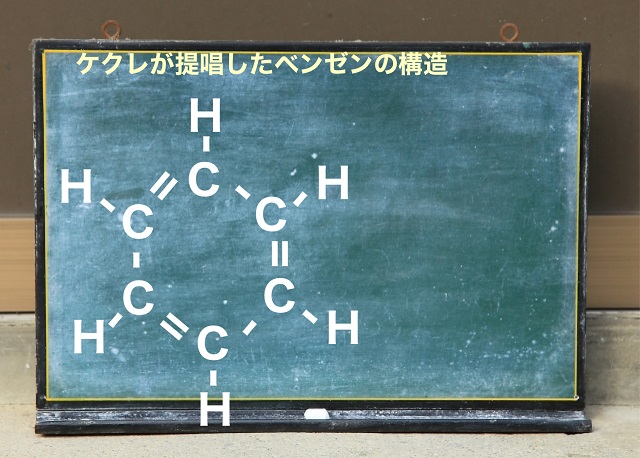
最終的にケクレという人がケクレ構造を唱えました。
ケクレが唱えた構造は上の図のようなものでした。
C6個、H6個で
二重結合と単結合が交互につながった構造だとケクレさんは主張しました。
ですが、二重結合と単結合が交互につながっていると困ることが起こります。
単結合>二重結合>三重結合
ということです。
・単結合の代表エタンの結合距離は1.53Å
・二重結合の代表エチレンの結合距離は1.34Å
・三重結合の代表アセチレンの結合距離は1.20Å
です。
このことは以下の記事で解説しています。
つまり、二重結合の方が単結合よりも短いということです。
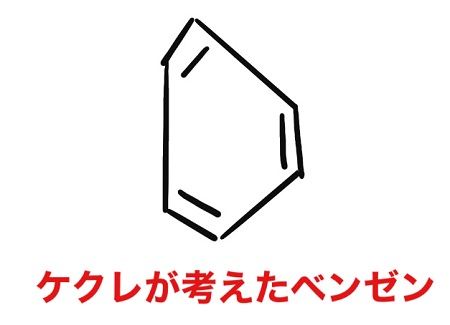
だから上記画像みたいにおにぎりみたいな形になります。
二重結合の方が単結合よりも短いので
短い長い、短い長い、短い長いという形になりますからね。
ですが、レントゲンを撮影して調べてみると
本物のベンゼンは正六角形です。
なのでケクレの構造も少しおかしい。
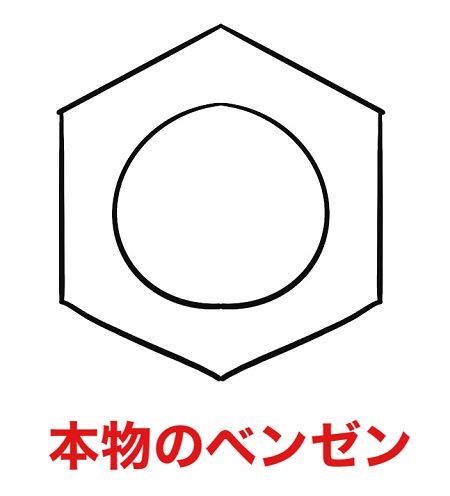
ということで現在では本物のベンゼンは六角形の中に丸という形で書くことが多いです。
ところでベンゼンというものについて考えるときには
ケクレの構造は偽物で、上記画像が本物だということになります。

ですがケクレの考えた構造というのは
これはこれでかなり優秀な構造です。
反応している様子を捉えるときには
すごく有用。
だからベンゼンというものについて考えるときには
偽物、本物を区別します。

でも、そのほかの場合には
ケクレの上記構造の『まま』で正六角形として考えようということになっています。
便利がよいケクレの構造はちょっとおかしいけど
必要悪として考えようということになりました。
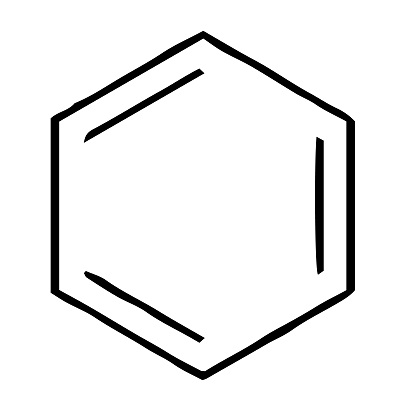
上記構造が、ケクレの考えた構造を正六角形化したものです。

本来なら二重結合は単結合より短いから
ケクレの考え方だと上記のようになりますけどね。
ケクレ構造というのはすごく便利がよいです。
だから高校の教科書ではケクレ構造を正六角形化して書きます。
大学の教科書でもケクレ構造は便利がいいという前置きをしたうえで
ケクレ構造でベンゼンの構造式を書いていることが多いです。
だから大学に行って専門的に有機化学を学習することになっても
ケクレ構造を必要悪として使い続けることが多いです。
ベンゼンの非局在化とは?
炭素は結合の手が4本ありますよね。
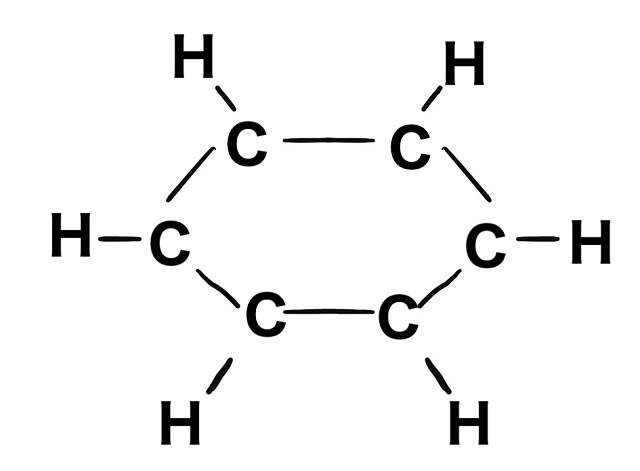
ということで上記画像のように炭素Cは結合の手4本のうち3本を使って
炭素と握手したり水素Hと握手したりしています。
炭素は手4本のうち3本使っているということは
手1本が余っていますよね。
結合の手というのは電子でしたよね。
余っている手1本は
もちろん電子1個です。
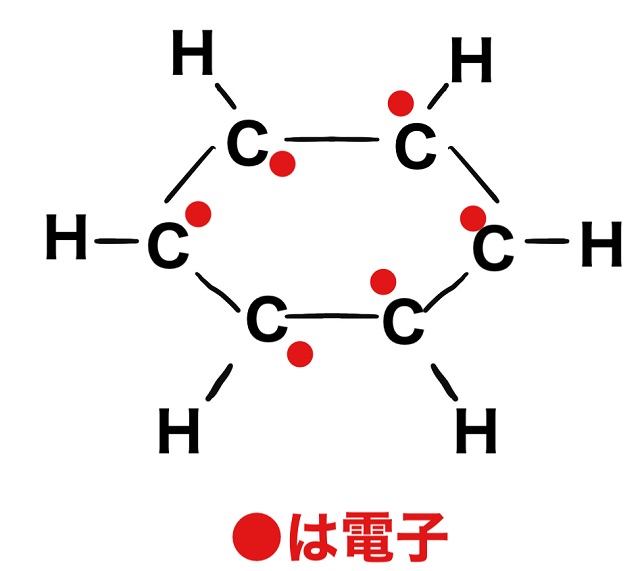
この余っている電子1個が上記画像のように
炭素原子の上、あるいは下をフラフラ動いています。
炭素原子の上、あるいは下
というのがポイントです。
何が言いたいか?というと、電子の移動範囲が狭いということです。

電子はもっと移動したいです。
人間でいったら4畳半の部屋で生活しているようなイメージです。

上記画像のように1つの電子を見ると
移動範囲は狭いですが、隣の電子だって移動範囲は狭いわけです。

そこで4畳半の部屋の住人(炭素にある1個の電子)が
6つある(炭素が6個あるから)ので
ベンゼン全体は4畳半の部屋が6つあるアパートだと考えることができますね。
そこで1つ1つは狭い部屋だけど
狭い部屋同士つないだらどうだろう?
みたいに発想してください。
そしたら広い部屋になりますね。
ということで全部つながって広い部屋にして
その広い部屋の中をグルグル回ろうとなるわけです。
あくまで化学です。
このように考えると理解しやすいよって話です。
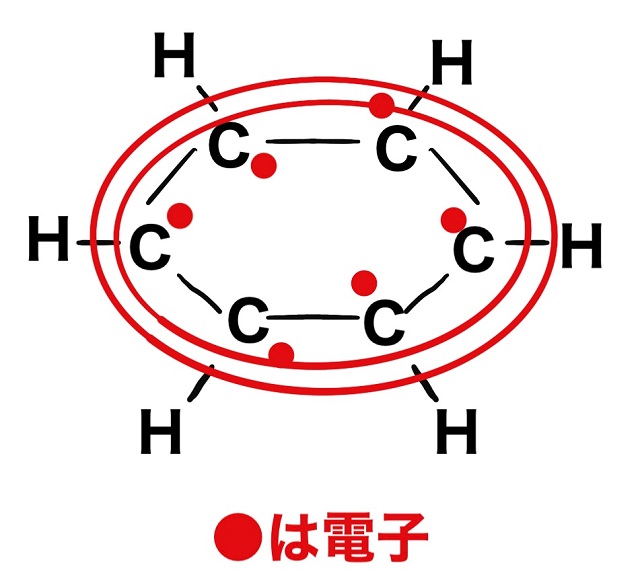
ということで6個の電子がベンゼン環の上、あるいは下をグルグル回っています。
このマイナスの電子が狭い所を嫌がって広い空間を動き回ること、
マイナスが広い空間に分散することを非局在化といいます。
非局在化は局在化に非ずということ。
局在は限られた場所にいることです。
だから非局在化とは限られた場所にいないということ。
なので局在していない、狭い空間にいないという意味です。
そうすると電子はストレスを感じないので
安定します。
つまり、非局在化すると安定化します。
そして正六角形になっているということです。
しかも平面です。
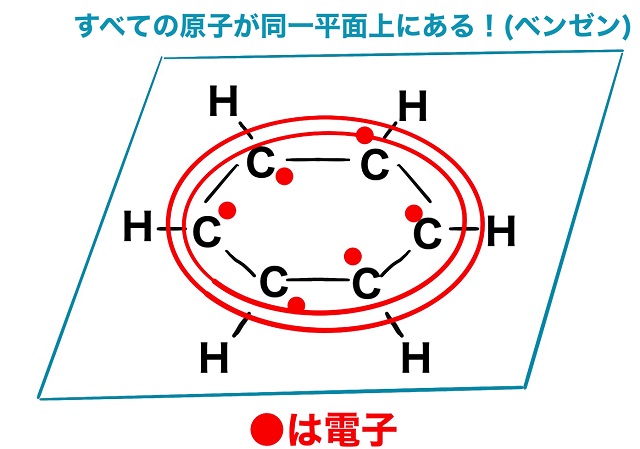
すべての原子が同一平面上にあります。
一枚の紙の上にあってしかもその形は正六角形だということです。

この正六角形の中に上記画像のように丸で表現したり、
ただ
ケクレ構造はケクレ構造で便利なので
上記画像のように表現したりします。
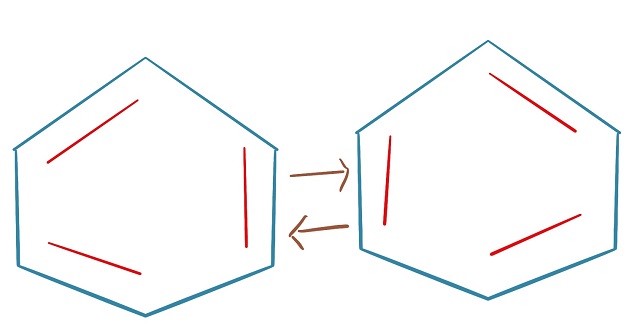
ただケクレ構造のベンゼンの場合は上記画像のように
左右の形をウロウロしていると考えることがあります。
左の形と右の形の間をずっと動いているような状態。
あるいは左右を重ね合わせたような状態だと説明されることがあります。

イメージとしては反復横跳びです。
おはようございます🕺🏻
本日の札幌は晴れ☀️
積もった雪が溶け始めています⛄️
今日は大人の身体測定🔥
反復横跳びにチャレンジ👍平均より20ポイント低い結果に😱
体が重いようで、動きが鈍いですね😇#おはようございます #企業公式が朝の挨拶を言い合う #企業公式冬のフォロー祭り #身体測定 pic.twitter.com/DtzPaKuVKP— タイヤセレクト豊平 (@DTh11901) February 14, 2023
反復横跳びしているしている人をずっと
眺めてみましょう。
すると残像が真ん中に見えてきますよね。
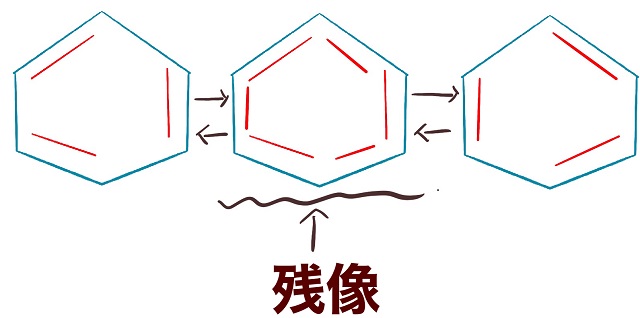
すると真ん中に見える残像は正六角形に見えるはずです。

それが上記画像だということです。
以上でベンゼンについての解説を終わります。















