今回の記事では電気陰性度とは何なのか、
わかりやすく解説していきます。
まずは電気陰性度を理解する前提となる電子配置から説明しますね。
電気陰性度の前提知識となる電子配置について
すでに電子配置については以前の記事で詳しく解説しています。
⇒電子殻の収容数が分からない方はこちら
なので、今回の記事では軽く復習という形になります。

一番内側がK殻でしたね。
そして、それぞれ定員(最大電子収容数)があるんでしたね。
n番目(一般項)・・・$2n^2 $個
K殻(n=1)・・・2個
L殻(n=2)・・・8個
M殻(n=3)・・・18個
N殻(n=4)・・・32個
O殻(n=5)・・・50個
($2×5^2 $=$2×25 $=50)
でした。
ここまでを前提に$Na $は原子番号何番でした?
原子番号は11です。
原子番号が11ということは電子$e^{ー} $も11ですね。
原子番号=陽子数=電子数
です。
原子番号が11なら電子数も11の意味が分からない方はこちらの記事をご覧ください。
⇒原子の構造について図を使ってわかりやすく解説
ではどんな配置で回っているのでしょうか?
ナトリウムの電子配置について考えてみましょう。
電子配置は内側からつめていくというのが基本的考え方になります。
ナトリウムは11個なので、K殻(内側からつめていくと)
・K殻・・・2個
・L殻・・・8個
・M殻・・・1個
となりますね。
すると一番外側のM殻だけたった1個だけ電子が
フラフラと飛んでいて取れやすいです。

なのでNa(ナトリウム)は電子が1個取れます。
電子は電気的にマイナスなので、ナトリウム自身はプラスになります
だからナトリウムはプラス1のイオンになり、ナトリウムイオンになります。
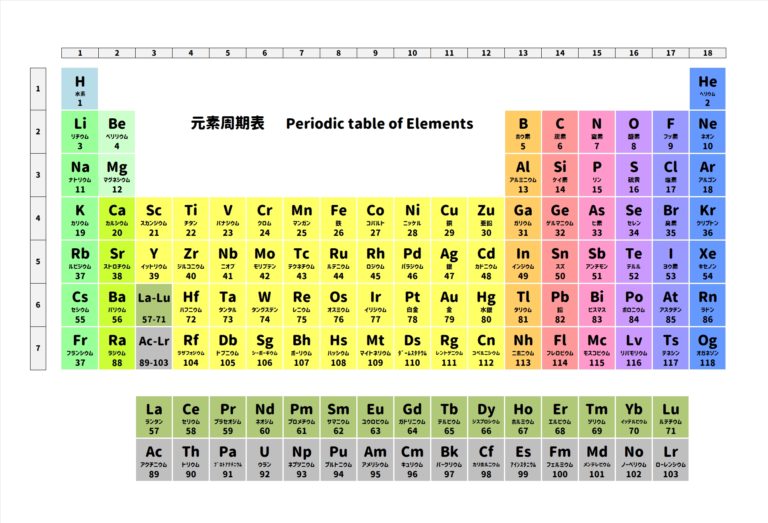
原子番号の順番に並べると周期表ができますが、
縦の並びを『族』といいます。
ナトリウムは周期表の一番左側の縦の列にいます。
だからナトリウムは『1族』です。
こんな感じでナトリウムとかリチウム、カリウムなどの1族は
みんな外側に電子が1個あります。
1族をアルカリ金属といいますが、アルカリ金属はナトリウムと似たような性質を持っていて
1価の陽イオンになりやすいです。
次に塩素($Cl $)について。
塩素の原子番号は17番です。
ということは電子は17個あります。
・K殻・・・2個
・L殻・・・8個
・M殻・・・7個
となりますね。
一番外側のM殻に7個電子が飛んでいます。

そしてM殻は8個で安定化します。
これを閉殻構造とかオクテットといいます。

タコは英語でオクトパスといいますね。
タコの足の本数は8個です。
オクテットはオクトパスを想像するとわかりやすいでしょう。
とにかくM殻は8個で安定化します。

塩素の最外殻電子は7個。
7個をばらまくよりも1個電子をもらった方が簡単です。
だから電子を1個受け取りやすいです。
つまり塩素は電子を1個もらい塩化物イオンになります。
$Cl $+$e^{ー} $⇒$Cl^{ー} $
となります。

塩素を周期表でみると、かなり右側にありますね。
右から2番目の縦の列に塩素Clは存在しています。
塩素が在籍している縦並びの族を17族、名前はハロゲンといいます。
ハロゲンの元素はみんな最外殻電子は7個で、みんな1個電子を欲しがります。
なのでハロゲンは一般に1価の陰イオンになりやすいです。
これでようやく電気陰性度について説明できるようになりました。
電気陰性度とは?
もしあなたが化学結合について理解を深めたいなら
電気陰性度の理解は必須です。
電気陰性度とは電子$e^{ー} $を引き付ける強さのことです。

周期表において下に行けば行くほど電気陰性度は小さくなります。
周期表で下に行くということは原子番号が増えて電子の数が増えます。
すると電子は失いやすいです。
たとえば原子番号が3番のリチウムLiなら最外殻電子はL殻で1個ですが
もっと原子番号が多い(周期表がリチウムより下の)11番のナトリウムは最外殻電子はM殻で1個です。

こんな感じで原子番号が増えれば増えるほど、
K殻⇒L殻⇒M殻⇒・・・
みたいに原子核からみたら外側がどんどん大きくなっていくわけです。
となると、電子を失いやすいです。
一番外側にいる電子が遠くなればなるほど
原子核から見たらめちゃくちゃ遠くなり
コントロールできませんから。ひきつける力はどんどん弱くなります。
たとえば同じ1族でも下に行けば行くほど(原子番号が大きくなる)
⇒一番外側の電子と原子核の距離が離れる
⇒電子をひきつける力が弱くなる
ということです。
たとえばLi(リチウム)とNa(ナトリウム)は同じ1族ですが、
LiよりNaの方が周期表で見たら下にあるので
リチウムよりナトリウムの方が電子を惹きつける力は弱いです。
ここで電気陰性度とは電子$e^{ー} $を引き付ける強さのことでした。
なので、同じ族でも周期表で見て下に行けば行くほど電気陰性度は小さくなります。
周期表で見て下に行けば行くほど
⇒電子をひきつける力は弱くなる
⇒電気陰性度は小さくなる
ということです。

それから周期表で同じ横並びであっても
左へ行けば行くほど、電気陰性度は低くなります。
たとえばNa(ナトリウム)とCl(塩素)は横の並びは同じですが
ClよりNaの方が左側にありますね。
となると、Naの方がClより電気陰性度は低いです。
ではどうして周期表の左に行けば行くほど電気陰性度は小さくなるのでしょう?
周期表の一番左側って1族(ナトリウムやリチウムなど)です。
最外殻電子に1個しか電子が飛んでいません。
だからすぐに電子が取れるんでしたね。
電子が取れやすいということは電子をひきつける力としてはすごく弱いです。
電気陰性度とは電子$e^{ー} $を引き付ける強さのことだから
周期表の左に行けば行くほど電気陰性度は小さくなります。
周期表の左へ行けば行くほど電子が取れやすい
⇒ということは電子をひきつける力は弱い
⇒電気陰性度は小さくなる
ということです。
・周期表の左下に行くほど電気陰性度は小さくなる
ということがわかります。
・周期表の右上に行くほど電気陰性度は大きくなる
ということでもあります。
当たり前の話ですね。
ということで、電気陰性度が最大の元素は『フッ素(F)』です。
これくらいは知っておいた方がよいかもしれませんね。
電子をひきつけるのはハロゲンが一番強いです。
ハロゲンの中で一番周期表的に上にいるのがフッ素。
だからフッ素が一番電気陰性度が大きくなります。
電気陰性度とは?まとめ
span class=”c-red”>電気陰性度とは電子$e^{ー} $を引き付ける強さのことです。
・周期表の左下に行くほど電気陰性度は小さくなる
・周期表の右上に行くほど電気陰性度は大きくなる

非金属(金属でないもの、例:炭素とか酸素とか塩素のこと)って
周期表の右上の方に固まっていますね。
周期表の右上の方って電気陰性度は大きくなるんでしたね。
ということは非金属って電気陰性度が大きくなるわけですね。
逆に金属は左下の方に多いため、電気陰性度が小さいです。
・非金属(酸素とか炭素とか)は周期表の左上にある⇒電気陰性度が大きい
・金属は周期表の右下の方にある⇒電気陰性度が小さい
ということです。
誤解を恐れずにいうと非金属は欲張り屋さんです。
常に電子を欲しがっています。
逆に金属は電子をあげたがっています。
こういうイメージをしっかりと思っておくことで
化学結合の理解がしやすいと思います。
以上で電気陰性度についての解説を終わります。