以前の記事で原子量について解説しました。
⇒原子量とは?計算の仕方とともに簡単にわかりやすく解説
他にも式量や分子量についても解説しました。
⇒式量と分子量の違いをわかりやすく解説
読んでて眠くなるし、「なに言ってんだよ!」みたいな話だったかもしれません。
そこで今回の記事では原子量とは何なのか、
化学嫌いの方に向けて平たく解説してみたいと思います。
原子量とは?わかりやすく説明します!
・0.00004グラムのA
・0.00005ブラムのB
・0.00006グラムのC
があったとしましょう。
0がいっぱいついてますね。

別にこのままでも
一生懸命、目を凝らしながら電卓をパチパチやって
計算することもできるでしょう。
でも0がいっぱいついてたら計算ミスをしやすくなりますよね。
やっぱり貸借対照表とか、損益計算書作るときに、仕訳はできてるのに、0が足りなかったり、計算ミスして間違えることが多い…😓
— 👘そらちゃ|WAFUKU GEN (@sora200826) February 4, 2021
しかも0.00004グラムとか軽すぎて想像もできませんよね。
結局、AとBやCを比べて重いか軽いか知りたいといったときに
0.00004グラムみたいな0が多い数字だと判断しづらいわけです。
ではどうしましょう?
もっと簡単に表現できないものでしょうか?
たとえばAよりCの方が何倍重いか?みたいなことを知りたいと思った時に
0.00004グラムみたいな細かい数字を使わなくても計算できますよね。
たとえば、
・0.00004グラムのA
・0.00005ブラムのB
・0.00006グラムのC
があったときに
Aを4とおくと、Bは5になりCは6に自動的に決まりますよね。
だってAの0.00004×10万=4なので、BもCも同様に10万倍すればBは5、Cは6になりますからね。
そしてABCをそれぞれ4,5,6とすることで
簡単にどれが一番重いか一瞬に判断することができますね。
もちろん、Cが一番重いとすぐにわかります。
こんな感じで0.00004みたいな細かい数字を使わずに
4みたいなわかりやすい新たに数字を置きなおして比較した方が
物事を判断しやすくなります。
こういう考え方があるわけです。
で、A、B,Cでどれが重いか判断するためには基準が必要です。
Aを4と置くと決めたらB、Cも決まりますね。
さっきみたいにAを10万倍するなら
同じようにB,Cも10万倍すればよいわけですから。
こんな感じで基準を決めたら残りが決まり
簡単に判断できます。
原子の世界も同様です。
原子も細かい世界でめちゃくちゃ軽いです。
0がいっぱい並ぶ世界ですから。
そのままだと0がいっぱいあって頭が混乱します。
ドラクエでいったらメダパニをかけられたみたいな状況になります。
⇒【新価格版】ドラゴンクエストXI 過ぎ去りし時を求めて S
ドラクエで例えると
従業員にバイキルトやスカラをかけてあげるのが上司やな!
会議でメダパニを唱えて皆混乱させたり、いきなり電話してルカニを唱えたりしたらそりゃ良い結果でないでしょって上手くドラクエで例えれたつもり笑
AI 『みんながんばれ』やな!!— アインズK社長 北村一樹 (@kitamura00730) January 19, 2021
だからもっと簡単に計算できるようにならないかな?
と考えたわけです。
そこで、
・0.00004グラムのA
・0.00005ブラムのB
・0.00006グラムのC
のAならAに基準となるものを作ろうと考えたわけです。
ということで基準が決められました。
しかも化学と物理で基準を統一しようと国際ルールで決められたのです。
具体的には質量数12の炭素を基準にしようと決めました。
${}^{ 12 } C $という表記をします。
これは国際ルールだから覚えておきましょう。
質量数12の炭素(${}^{ 12 } C $)ですが
陽子、中性子、電子を足し合わせた原子1個の質量を12と置きました。
これが基準です。
${}^{ 12 } C $=12
という基準にしたということです。
たとえば、質量数が63のCu(銅)で考えてみましょうか。
質量数が63の銅は${}^{ 63 } Cu $は${}^{ 12 } C $の何倍重いでしょうか?
計算結果は62.9になりました。
それから質量数が65の銅は${}^{ 65 } Cu $は${}^{ 12 } C $の何倍重いでしょうか?
すると64.9になりました。
こんな感じで${}^{ 12 } C $という基準に対して
何倍重いか?を1つ1つ研究者が計算してくれています。
まとめると
・${}^{ 63 } Cu $は62.9
・${}^{ 65 } Cu $は64.9
となりました。
これだと扱いやすいですよね。
${}^{ 12 } C $の左上の12という数字は
陽子の数と中性子の数を足したものですが、
これは${}^{ 12 } C $=12におけるイコールの先の基準である12と一致しています。
また、${}^{ 63 } Cu $=62.9も${}^{ 65 } Cu $=64.9
もほぼ同じくらいの数字になってますね。
たとえば、${}^{ 63 } Cu $の左上の数字63とイコールの先の62.9と
ほぼ同じくらいの数字になってますよね。
これは${}^{ 12 } C $=12という基準を作って
${}^{ 63 } Cu $の重さを考えた結果そうなったわけです。
このようにするとイメージが湧きやすくなりましたよね。
そして${}^{ 63 } Cu $の62.9や${}^{ 65 } Cu $の64.9という数字は
62.9や64.9という形できちっと計算するときもありますし、
大雑把に${}^{ 63 } Cu $を63、${}^{ 65 } Cu $を65とするときもあります。
たとえば銅を拾ってきて、
その中の銅を調べてみたところ、
・${}^{ 63 } Cu $=62.9のものが69.2%
・${}^{ 65 } Cu $=64.9のものが30.8%
存在していたとしましょう。
するとまた問題が生じます。
どういう問題でしょう?
拾ってきた銅を燃やすとか
濃硫酸と加熱して反応させようとしたとしましょう。
その場合、いちいち
・${}^{ 63 } Cu $=62.9のものが69.2%
・${}^{ 65 } Cu $=64.9のものが30.8%
上記2つのパーセンテージを区別するでしょうか?
しないと思います。
一般的に拾ってきた銅は銅でしょう。
${}^{ 63 } Cu $という軽いものと${}^{ 65 } Cu $という重いものを
ひっくるめて実験したり研究したりします。
私は獣医師ですが大学の実験でもそうでした。
⇒プロフィール
すると銅の原子量を求めてくださいみたいな問題が出たら
${}^{ 63 } Cu $という軽いものと${}^{ 65 } Cu $という重いものが混ざっているから
平均値を出さないといけません。
たとえば、30㎏の体重の人が2人、20㎏の体重が2人いたとしましょう。
この場合、平均値は全員の体重を足し算して(この場合、100㎏となる)
全員の人数、この場合4人で割り算すればよいですね。
なので100㎏÷4人=25㎏
平均値は25㎏となりますね。
これと同様、銅の場合も
${}^{ 63 } Cu $という軽いものと${}^{ 65 } Cu $という重いものが混ざっているから
平均値を出さないといけません。
ということで
(62.9×69.2+64.9×30.8)÷(69.2+30.8)
=63.5
となります。
こういうのを原子量といいます。
・${}^{ 63 } Cu $=62.9のものが69.2%
・${}^{ 65 } Cu $=64.9のものが30.8%
上記のような細かい数字を調べて平均をとったら原子量となるわけですね。
これでもよくわからなかった方のために
以下、さらに別の切り口で原子量について解説していきますね。
原子量とは?別の表現でわかりやすく説明
ざっくり原子量とは何か?説明しますね。
原子量とは人が勝手に決めた原子1個の重さのことです。
原子っていうのはこちらの表に示されている1つ1つのことです。
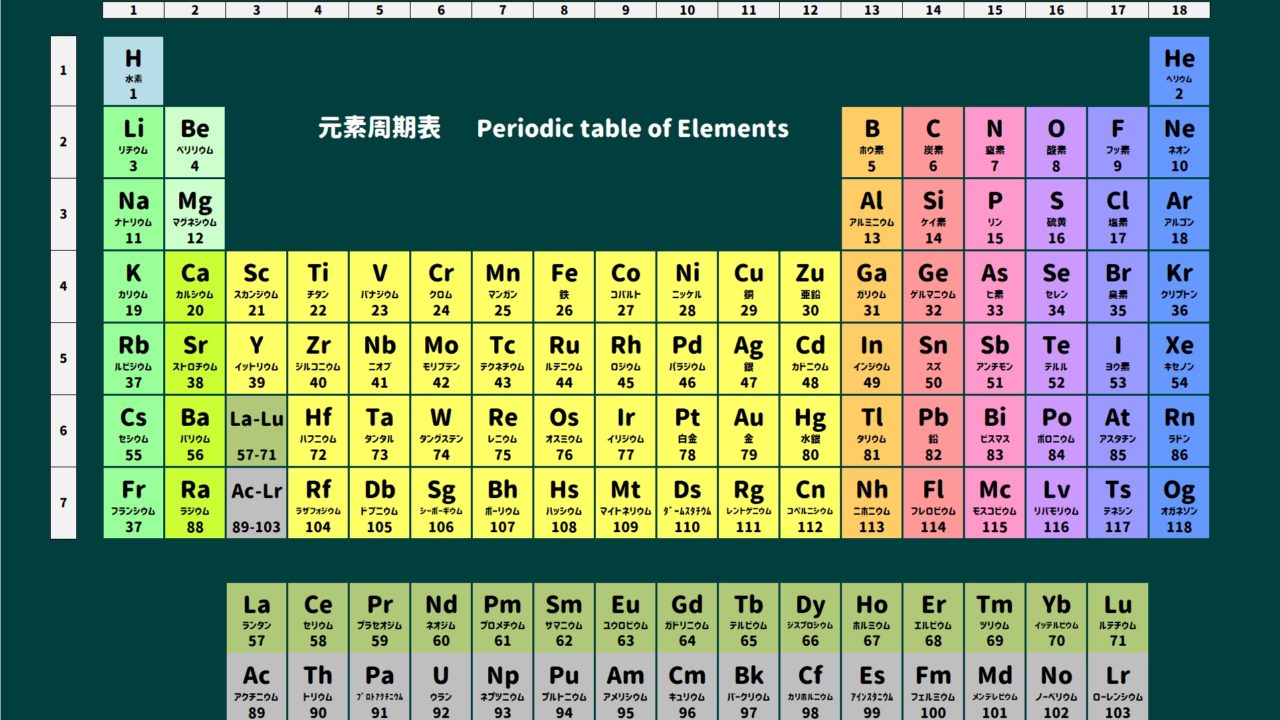
たとえば酸素Oは原子ですし、ナトリウムNaも原子です。
さらに詳しく原子について知りたい方はこちらをご覧ください。
⇒原子の構造について図を使ってわかりやすく解説
これら原子1個の重さのことを原子量っていいます。
たとえば、ヘリウム原子Heの原子量は4.003で水素原子H、1個の重さは1.008で
人が勝手に決めています。
他にもリチウム原子Li、1個の重さは6.941です。
原子量には単位はありません。
本の重さが100グラムみたいな単位は原子量にはありません。
こんな風に原子量ってありますが
数値までは暗記不要です。
もしあなたが受験生であれば
必ず問題文に原子量は記載されています。
もし問題文に原子量が記載されていないなら不要だと考えても問題ないでしょう。
ただし、原子量はC=12、H=1、O=16とする。
みたいに記載されていたりします。
だから受験目的で原子量を勉強していて
「原子量、よくわからないよ」と思っていても、
そんなに心配しないでください。
問題文に記載されていますから。
だから、原子量とは人が勝手に決めた原子1個の重さのこと
くらい覚えておけば良いでしょう。
ただ、国公立大学の化学受験だったら、こちらの記事で原子量の理解を深めておいた方が無難かもしれません。
⇒原子量とは?計算の仕方とともに簡単にわかりやすく解説