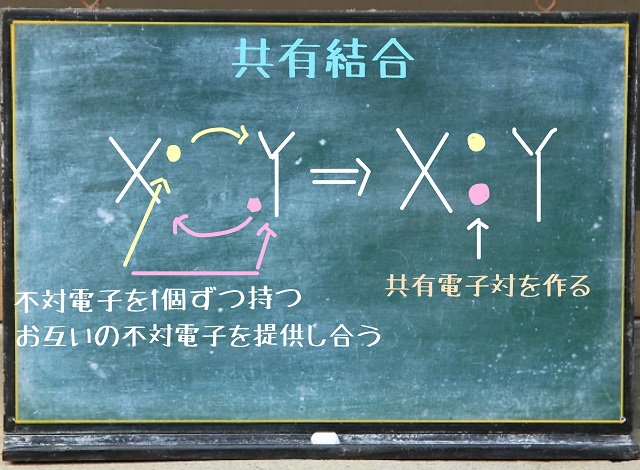今回の記事では化学結合の種類について解説しますが、
電気陰性度の知識が大前提になります。
もし電気陰性度のことがわからない場合には
先にこちらの記事をご覧ください。
⇒電気陰性度とは?わかりやすく解説
Contents
化学結合とは?
そもそも化学結合とは何か、ご存じでしょうか?
化学結合とは原子間の結合のことです。
化学結合の種類は大きく分けて3種類あります。
・金属と金属
・金属と非金属
・非金属と非金属
の3種類あります。
これから解説する化学結合は必ず上記のどれかに該当します。
では具体的にみていきましょう。
化学結合の種類:金属結合(金属と金属の結合)
前回解説した電気陰性度を覚えていますか?
⇒電気陰性度とは?わかりやすく解説
金属って電子を放出したがるのでした。
だから電気陰性度は小さいわけですね。
ということは金属結合は金属と金属の結合なので
お互いが電子を放出したがるわけです。
そのため、余った電子が大量に存在しています。
この余った電子を自由電子と言います。
自由電子は読んで時のごとく
金属の塊の中を『自由に』動くことができます。
電子が自由に動いているということは電気を通すということです。
電気を通すことを導体と言います。
なので金属結合は導体としての性質があります。
熱もよく通しますし
展性、延性に富みます。
展性、延性についてはこちらの記事で詳しく解説しています。
⇒金属結合の特徴をわかりやすく解説
もしあなたが空手をやっている、
あるいはやったことがあるなら理解しやすいかもしれません。
鉄板をエイヤーと手刀で叩いてみてください。
瓦だったら割れるかもしれませんが
鉄板は割れませんね。
もしかしたらグニャッと延びるかもしれませんが。
つまり力を加えて配置が変わっても
そこにすぐに自由電子が間に入ってくるので
壊れないのです。
壊れないということは変形しやすいということです。
これが展性、延性の理屈です。
展性というのは展覧会の展で二次元を意味します。
展とは平らに広げて並べることですからね。
三次元の立体ではないということです。
なので展性とは金箔のように薄っぺらく伸ばすことです。
それから延性ですが。
延性の延は延長の延です。
時間を延ばす。時間って一次元ですね。
時間って現在から見たら過去と未来という1方向しかありませんからね。
時間って直線的に流れているってことです。
昨日から現在、明日と一直線に時間が流れるから一次元です。
一次元というのは直線しかない世界のことです。上方向や下方向とか奥の方向とかありません。
ただのまっすぐな線です。
とにかく延性は時間の延長の延で一次元だから
針金のように細長く伸びます。
針金って簡単に曲がって変形しやすいですよね。
だから延性っていうのはだから変形しやすいってことです。
配列が変わっても自由電子が入ってくるので壊れにくいです。
壊れないということは変形しやすいってことです。
これは自由電子があるからこそできる話です。
化学結合の種類:イオン結合(金属と非金属の結合)
たとえば$NaCl $(塩化ナトリウム)ですが、
$Na $は金属で、$Cl $は非金属です。
ですから、$NaCl $は金属と非金属の結合でできています。
電気陰性度のところで解説しましたが、
金属は電子をあげたがりますし、
非金属は電子をもらいたがっています。
⇒電気陰性度とは?わかりやすく解説
ナトリウムは金属、塩素は非金属ですから
・$Na $⇒$Na^{+} $+$e^{ー} $
・$Cl $+$e^{ー} $⇒$Cl^{ー} $
となります。
経済学的にいったら需要と供給のバランスが成り立っている状態ですね。
電子を出したがっているナトリウムと電子をもらいたがっている塩素って
商品を売りたがっている(出したがっている)お店と商品をもらいたがっているお客さんみたいな感じです。
だからナトリウムと塩素で塩素の取引が成立するわけですね。
つまり、電子の受け渡しが成立してイオンになってしまいます。
ナトリウムイオン$Na^{+} $と塩化物イオン$Cl^{ー} $になるということです。
ここでプラスのイオンとマイナスのイオンが同じ場所に存在していますね。
プラスとマイナスが引っ張り合いますね。
このプラスとマイナスが引っ張り合うことを静電気力といいます。
静電気力はクーロン力ともいいます。
これがイオン結合の正体です。
金属と非金属の場合、
電子を与えたい方ともらいたい方の利害が一致するため
プラスとマイナスのイオンが発生し引っ張り合う力(静電気力、クーロン力)が発生し
イオン結合ができるわけですね。
簡単にいうと、イオン結合とはプラスとマイナスが引っ張り合う力(クーロン力、静電気力)です。
化学結合の種類:共有結合(非金属と非金属)
非金属同士ということはお互いが電子をもらいたがっているわけですね。
わからない方は電気陰性度の記事をとにかく読んでほしいです。
⇒電気陰性度とは?わかりやすく解説
例として酸素を考えましょう。
・K殻に2
・L殻に6
ですね。
なので最外殻電子(価電子)は6個ですね。
ということは後、電子を2つほしい状態です。
L殻は8個で安定しますからね。

上記は酸素の電子式です。
酸素は価電子が6個です。
だから表面には6個しかありません。

お互いに「俺に2個電子をくれ!」と戦っても仕方ありません。
そこで真ん中の緑色の電子を2個ずつ出し合って共有します。
結果、お互いの酸素が電子数8個になった「つもり」になります。
これで安定化しているわけです。

そして上記画像のように1つの箱の中に2個の電子が入っています。
この箱を共有電子対といいます。
2個入っているから「対(つい)」です。
この場合は共有電子対が2つ(2つの電子が入った箱が2つ)ありますね。
この共有電子対が共有結合の正体です。
お互いが電子を共有することによって結合するから共有結合です。

他の電子対は共有してないので
非共有電子対といいます。
化学結合の種類:配位結合(共有結合の特殊タイプ)
配位結合はあくまで共有結合です。
お互い電子を出し合う話の特殊型です。
ここではアンモニアを例に考えてみましょう。
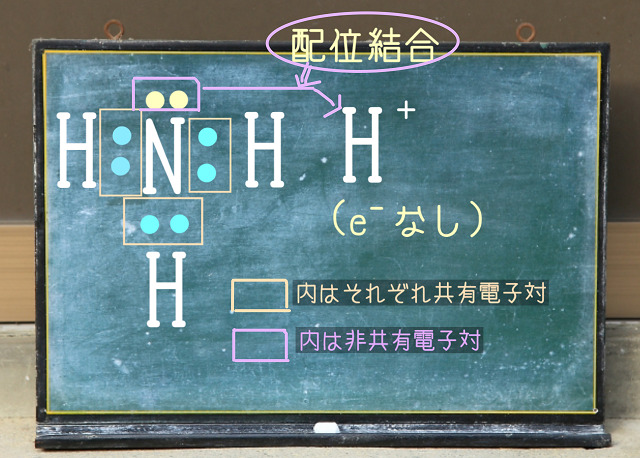
アンモニアの場合、上記図の左側のような感じになります。
ここに水素イオン($H^{+} $)(上記図の右側)がやってきたとしましょう。
水素は原子番号が1番です。
だから電子数は1個です。
その1個しかない電子が飛んで入ってしまったのが水素イオンです。
なので水素イオンには$e^{ー} $(電子)がありません。
水素イオンは電子がないので電子を欲しがっています。
でも電子を水素イオンは持っていません。
だからさっきのような共有結合ができないように思えます。
だって共有結合はお互い電子を出し合う結合でしたから。
でも、アンモニアさんは優しいです。
電子を持っていない水素イオンに対して
アンモニアの非共有電子対の2つの電子を両方とも
出してあげます。
これが配位結合です。
配位結合の場合は非共有電子対がないとできませんから
注意してください。
以上で解説を終わります。