理科、特に化学目線で電池とは何か?、一言でいうなら
酸化還元反応が関係する仕組みだといえます。
酸化還元反応を利用して電子を外部に流すことで
電池ができています。
酸化還元反応は結構身近な反応だと思うぞぉ。
酸化反応だと洗濯だったりカイロだったり…。
酸化還元両方してんのが電池だ!
身近な物でも化学反応は結構あっぞぉ— 化学がそれなりに出来る孫悟空 (@kagakugokuu) March 6, 2022
ではどのような仕組みで電子が流れているのでしょう?
Contents
電池とは?理科の授業っぽく解説
たとえばスマホやパソコンはリチウムイオン電池という電池を使っています。
スマホのリチウム電池発明した人にノーベル化学賞か…
あれってそんなに凄い発明だったのか。
流石に「何の役に立つ研究なんですか?」と聞く記者はいないよな。— ねむりねこ狂四郎 (@nemurineko4989) October 9, 2019
宗谷岬にて
今年7月末で本当に最後のPHS達イエデンワの電池として単3型電池が使われているが
アルカリ/マンガン電池の使用環境は
5~45℃
外気温-9℃としてもココはかなり酷な環境スマホなどに使われているリチウム電池は-40℃〜60℃なので
寒冷地では必須PHS電波強度 圏外#旅するイエデンワ pic.twitter.com/TKkPCXo3II
— せい (@nhdaua) December 31, 2019
ちなみに乾電池はマンガン電池です。
電池って実は星の数ほどあります。
それぞれの負極や正極で起こる反応はそれぞれ違ってきます。
どんどん新しい電池が開発されています。
なので、この記事では有名な電池について解説しながら
電池とは何か?一緒に考えていきましょう。
電池とはいったいどんなもの?
具体的にどんな反応をするかは電池の種類によって様々です。
ただ。大きく原理としては共通するものがあります。
すべての電池に共通するものを説明していきます。
電池というのは酸化剤と還元剤の反応によって作られています。
⇒酸化剤と還元剤語呂を使った覚え方

上の図のように酸化剤と還元剤を接触させたとしましょう。
酸化剤が相手から電子を奪い取ります。
電子を奪われるものを還元剤、電子を奪うものを酸化剤と定義されていますからね。
対象物を酸化させる物質を酸化剤と言う。
酸化剤は結果として、還元される。
つまり、酸素を与えるor水素を奪うor電子を奪う物質のことである。
還元剤はその逆である。— さくや🎴s̪̭̱̼̼̉̈́ͪ͋̽🌙🎑@口が悪い (@XaqyaEXE) June 26, 2021
これって電子が酸化剤に動いているわけですが、
ですが、私たちが電池として利用できるものではありません。

なぜなら、上の図のようなタイプだと外に電子が流れないからです。
外に電子が流れないと電球をつけたりモーターを回したりできません。
これは完全に失敗です。
こういう電池を局部電池といいます。
局部電池みたいに1か所で酸化還元反応が完結してしまっては
電気を取り出すことができません。
局部電池は一般的な人間が利用できる電池としては失敗になります。
では身の回りにある電池っていったいどんな構造をしているのでしょう?
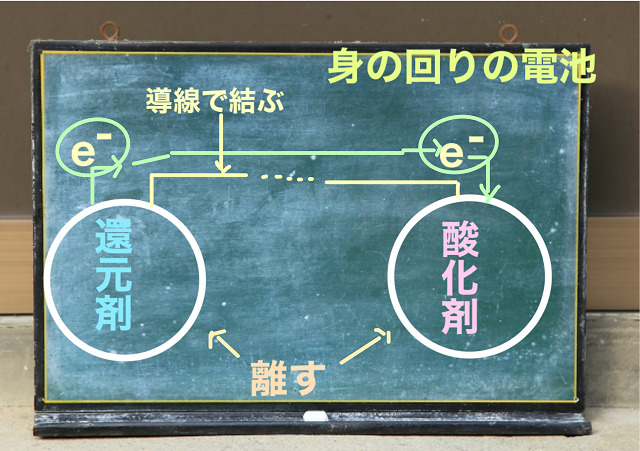
還元剤と酸化剤が離れています。
接触していません。
酸化剤と還元剤と離して導線で結びます。
すると、外を通して電子のやり取りが起こるようになるわけです。
外に電子が流れているから、電気を取り出すことができ
結果として電池として利用することができます。
もちろん、こんなシンプルな仕組みだけで電池として利用できるわけではありません。
寿命や耐久性、安全性などいろんな問題をクリアーする必要がありますから。
でも、まず『外に電子が流れること』が絶対条件です。
だから電池は極板は接触せず、必ず離れて存在してます。
電池において電子を放出する極板負極(ー)といいます。
つまり、還元剤として働くものが負極になっています。
そして電子を受け取る極板を正極(+)といいます。
なので、酸化剤が正極として働くことになります。
・還元剤・・・電子を奪われる(負極、ー極)
・酸化剤・・・電子を奪う(正極、+極)
です。
以上が電池とは何か?です。
ではここから具体的な電池について解説していきます。
理科(化学)の学習で知っておきたい電池とは?
ダニエル電池とは?
まずダニエル電池から。
ダニエル電池は教科書に掲載されている電池としては一番古いものになります。
昔はボルタ電池が一番古い電池でした。
でも、ボルタ電池は現在では電池としてみなさないことになっています。
なので、ダニエル電池が一番古い電池になります。
ちなみにダニエル電池はダニエルさんが発見したからダニエル電池です。
もし、山田さんが発見してたら山田電池となっていたでしょう。
「ヤマダ電機みたい!」って突っ込まれそうですね(苦笑)。
「ボルタ電池で起こる分極という欠点を改良したのがダニエル電池」
と言うより
「ボルタ電池で起こる分極という欠点を改良したのがダニエル電池。さすがキティちゃんの彼氏だね」
と言った方が電池の名前を一発で覚えるのでファボゼロのボケは偉大
— ヨビノリたくみ😬 (@Yobinori) April 21, 2019
84.【ボルタ電池誕生の裏側?カエルの脚】#かがく #ボルタ電池 #カエルの脚 pic.twitter.com/5Rv2nDpEm8
— まろかがく🧪 (@maro_study_) July 8, 2021
ダニエル電池っていったいどんな仕組みを利用しているのでしょう?
イオン化傾向の違いを利用しています。
⇒イオン化傾向の特徴についてわかりやすく解説
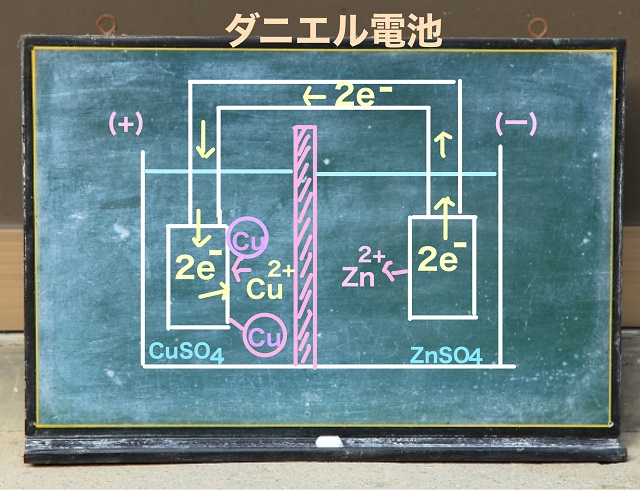
亜鉛と銅を極版にします。
亜鉛が浸っている水溶液が$ZnSO_4 $で、銅は$CuSO_4 $の水溶液に浸っています。
イオン化傾向は亜鉛の方が大きいです。
【重要】 Q 金属のイオン化傾向について、イオン化傾向が強い金属の元素からすべて答えよ。 A K(カリウム) Ca(カルシウム) Na Mg Al Zn(亜鉛) Fe(鉄) Ni(ニッケル) Sn(スズ) Pb(鉛) Cu(銅) Hg(水銀) Ag(銀) Pt(白金) Au(金)
— 公務員用 生物&地学&化学一問一答bot (@seibutsugakubot) March 10, 2022
だから亜鉛板から$Zn^{2+} $(亜鉛イオン)が先に陽イオンとなって溶けていきます。
$Zn^{2+} $となったとき、同時に電子$2e^{-} $が放出されることになります。
そのとき放出された電子$2e^{-} $が導線を通って反対側の極板(銅板)にやってくるわけです。
なので、亜鉛が負極、銅板が正極となります。
電子を受け取る側が酸化剤(正極)ですからね。

正極にやってきた電子は誰が受け取るでしょう?
これは水溶液中にある陽イオンです。
電子はマイナスの電荷をもった粒ですから
正電荷を持った粒(+)に受け取られます。
水溶液中には$Cu^{2+} $(銅イオン)という陽イオンがありますからね。
銅イオンが電子をもらって単体の$Cu $(銅)が析出します。
これがダニエル電池の反応です。
・(負極)$Zn $⇒$Zn^{2+} $+$2e^{ー} $
・(正極)$Cu^{2+} $+$2e^{ー} $[⇒$Cu $/box04]
です。
ダニエル電池は1800年代に作られた電池なので
かなりシンプルです。
でも、電気を取り出すことに成功したことについては歴史的意義は大きいでしょう。
ダニエル電池は硫酸銅水溶液に銅板、硫酸亜鉛水溶液に亜鉛板をつけて、それを素焼き板で仕切ったり、別々のビーカーに入れて塩橋をかけたりしたもの。
亜鉛が電子を失って溶け、その電子を受け取って銅が析出。この反応はともに電子が2つ関係するから、両極板の合計物質量は不変も、合計質量は増える— やまてつ (@yamatetsu2010) March 9, 2022
ボルタ電池は希硫酸中に銅と亜鉛を浸したもの。
ダニエル電池は硫酸銅水溶液中に銅、硫酸亜鉛水溶液中に亜鉛を浸して、それらをセロハンで仕切ったもの。
後者は水素が発生しないため、効率がいいんだよ。— 化学のことなんか全然好きじゃ( (@ukichemical_bot) March 11, 2022
鉛蓄電池(なまりちくでんち)とは?
鉛蓄電池は車のバッテリーなどに利用されている電池です。
エンジンをかける一発目、ガソリンに火花を飛ばして点火するのですが、
この電気火花を飛ばすのが鉛蓄電池の大きな仕事です。
82.鉛/Lead(Pb)
原子量:207
融点/沸点:328℃/1740℃全元素中で最も質量数の大きい安定同位体をもつ元素。
毒性があるが用途は様々で、自動車のバッテリーに使われる鉛蓄電池や釣りのおもり、放射線遮蔽材等がある。pic.twitter.com/KGlXABQwzz— えれめんとりびあbot (@elementriviabot) March 9, 2022
鉛蓄電池の極板ですが、$Pb $(鉛)と$PbO_2 $(二酸化鉛)です。
ではどうしてこれで電子が流れるのでしょう?
そもそもイオン化傾向に差はありませんからね。
同じ鉛ですからね。
⇒イオン化傾向の特徴についてわかりやすく解説
ではどうして$Pb $(鉛)と$PbO_2 $(二酸化鉛)を導線で結ぶと
電子が流れるのでしょう?
鉛蓄電池、正極は酸化鉛(Ⅳ)、負極は鉛。両方とも硫酸イオンと反応して硫酸鉛(Ⅱ)になるから、そこからイオン反応式を立てれれば正極負極は判断できるね。
— 化学のことなんか全然好きじゃ( (@ukichemical_bot) March 11, 2022
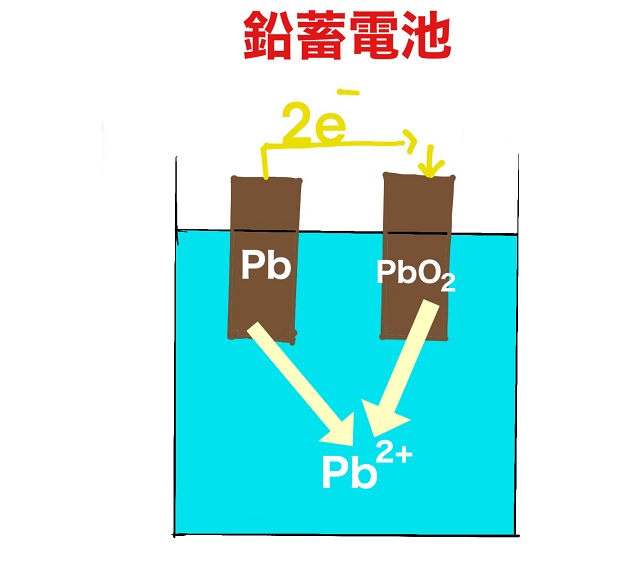
それはイオン化傾向の違いではありません。
酸化数の違いです。
$Pb $(鉛)の酸化数は0です。
$PbO_2 $(二酸化鉛)の酸化数は+4です。
$Pb $(鉛)とという金属は酸化数が+2になったときがもっとも安定した状態なのです。
鉛はいろんな酸化数になれます。
でも+2($Pb^{2+} $になりたいのです。
酸化数0の$Pb $(鉛)が$Pb^{2+} $
酸化数+4の$PbO_2 $(二酸化鉛)が$Pb^{2+} $になるには
どうすればよいでしょう?
$Pb $は電子を2つ捨てればよいわけです。
$PbO_2 $は電子を2つもらえばよいですね。
つまり、酸化数を安定な+2にするために電子の循環が起きているわけです。
よって、$Pb $(鉛)が負極、$PbO_2 $が正極になります。
燃料電池とは?
燃料電池は環境にやさしいクリーンな電池です。
反応後に水しかできないからです。
ただ、デメリットもあります。
値段が高いです。
まだまだ改良の余地がある電池です。
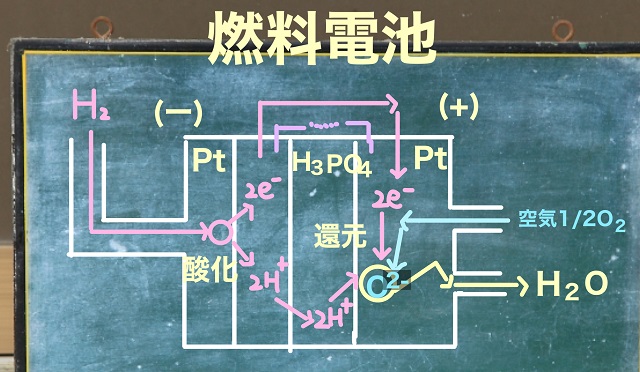
まず、片方の通気口から水素ガス($H_2 $)を吹き込みます。
白金板($Pt $)が触媒として使われています。
白金板は電気を通すというのでなく、水素ガスの酸化反応を促進する触媒として利用されています。
そして、水素イオン($H^{+} $)は水溶液中に出ていきます。

で、電子は反対側の極板に移動し、空気中の酸素($\frac{1}{2} $$O_2 $)と還元反応を起こし、
$O^{2ー} $(酸化物イオン)ができます。
この酸化物イオンはリン酸水溶液中($H_2PO_4 $)の$2H^{+} $とすぐに反応(中和反応)して
水($H_2O $)ができます。
これで反応が完結です。
こんな感じで水しかできていませんね。
なので環境にやさしいクリーンな電池だといえます。
燃料電池において負極として働くのは水素ガス($H_2 $)を吹き込んだ極板です。
そして酸素が反応する側の極板が正極です。
・(負極)$H_2 $⇒$2H^{+} $+$2e^{-} $
・(正極)$\frac{1}{2} $$O_2 $+$2e^{-} $+$2H^{+} $⇒$H_2O $
です。
理科分野における電池とは?電気消費量について
いかがだったでしょうか?
鉛蓄電池にしても燃料電池にしても流れた電子が何モルなのか?によって
どれだけの電気を消費したか?計算できます。
公式があります。
$e^{-} $(mol)=$\frac{電気量(C、クーロン)}{ファラデー定数} $
備考)ファラデー定数は96500(C/mol)
電気量は何A(アンペア)の電流を何秒間流したか?で
アンペア×秒数=電気量
です。
上記式で流れた電子の物質量が何モルかわかると
計算ができます。
酸化剤と還元剤が反応した時、電子が動きます。
この電子が動くことを利用した装置が電池です。
この電池を理解するためには半反応式の理解が必要です。
⇒半反応式の問題を解きながら作り方も覚えよう!
なぜなら半反応式が極板の反応式になりますからね。














