上記画像はオキソニウムイオンの電子式です。
なぜオキソニウムイオンの電子式に+が必要なのか?
理解するためには配位結合の知識が必須です。
なのでまず配位結合について解説したあと
なぜオキソニウムイオンの電子式に+が必要なのか?
理解できるようにわかりやすく解説していきます。
オキソニウムイオンの電子式
オキソニウムイオンの電子式を理解するための前提知識
まず今回の記事の内容を理解する大前提として
以下の記事の知識は必須です。
もしこれから解説する内容が意味不明だと感じた時点で
以下の記事を読んでみてください。
そうすれば『ほぼ必ず』わかります。
たとえば
・不対電子
・共有電子対と非共有電子対
・共有結合の結合の仕方(配位結合の結合の仕方の違い)
・電子式
・電気陰性度
です。
・高校化学の電気陰性度の覚え方教えます!
・電気陰性度と極性についてわかりやすく解説
・電子式書き方の決まりをわかりやすく解説
配位結合
配位結合は変わった結合です。
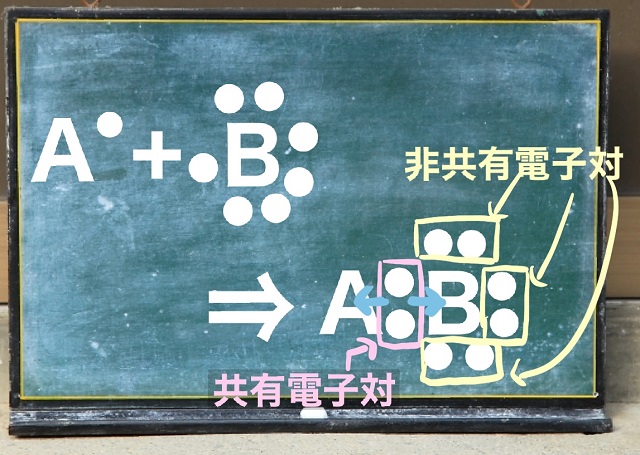
共有結合なら不対電子同士がお互いに手を出し合って結合しましたね。
⇒電気陰性度と極性についてわかりやすく解説
でも配位結合は違います。
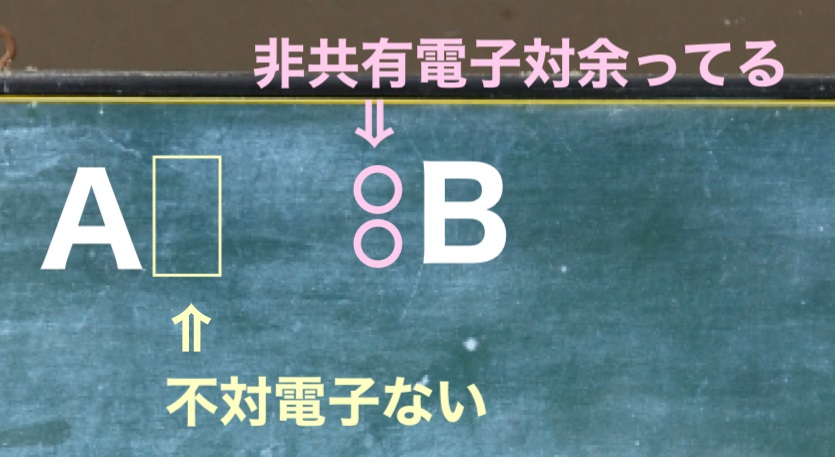
Aに不対電子はありません。
でもAは結合をすることができます。
これに対してBは非共有電子対が余っています。

そんな状況下でBが一方的に非共有電子対を提供します。
そして結合するのが配位結合です。
共有結合ならお互いに手を出し合ってくっついていたわけですが
配位結合は非共有電子対を一方的に提供して結びつきます。
オキソニウムイオン

もう少し具体的にいうと水素Hは最外殻電子が1個で
不対電子が1個あります。
酸素Oは最外殻電子が6個で不対電子が2つあります。
ココがよくわからない方はこちらを先にご覧ください。
⇒電子式書き方の決まりをわかりやすく解説
話を元に戻します。
お互いに不対電子を出し合って非金属同士ですから共有結合を作ります。
⇒電気陰性度と極性についてわかりやすく解説
これが水です。
水ってこんな感じの電子式になっています。
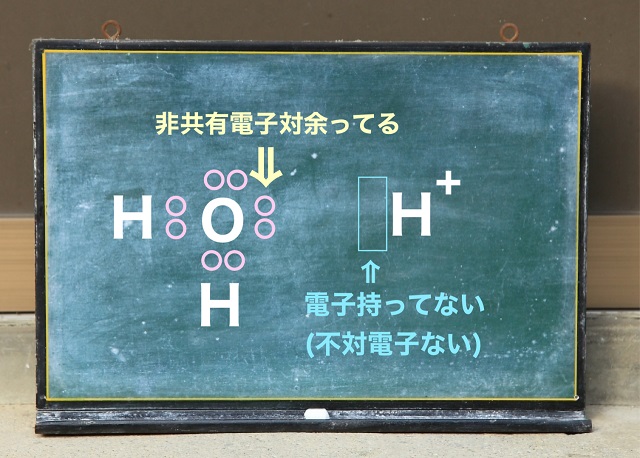
では水ってなんだ?
というと非共有電子対は上記図の左側を見ていただくといまだに余っています。
水素Hは最外殻電子は1個ですが
電子1個を失えば上記図の右側のようにプラス1になります。
だから$H^{+} $となるわけですね。
$H^{+} $になると電子を引き受けることはできますが
でも電子を持っていません。

さっきのAと$H^{+} $は同じ状況だということです。
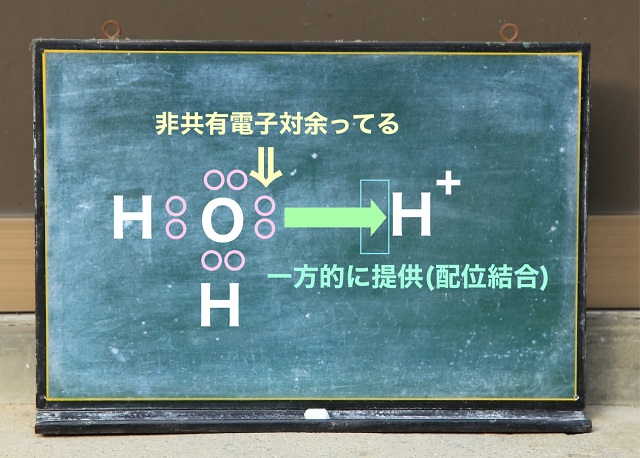
上記図の左側を見てください。
非共有電子対が余っています。
だから一方的に提供できます。
これを配位結合というんでしたね。
すると
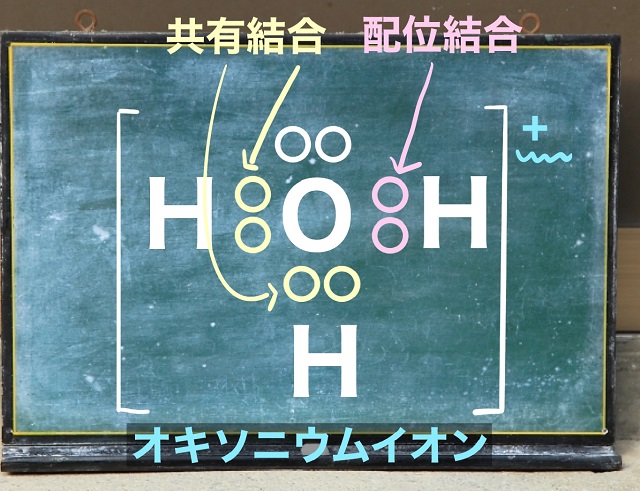
すると全体でプラス1になります。
これをオキソニウムイオンといいます。
名前を記憶しておいてください。
酸性とかアルカリ性だというを
どこかで聞いたことがあるかもしれませんが
酸性の原因になります。
⇒ブレンステッドローリーとアレニウスによる酸・塩基の定義の違いとは?

上記図のように電子に色を付ければ
配位結合や共有結合の場所が理解できますね。
非金属同士で電子を出し合ってあれば共有結合ですからね。
でも現実に電子に色はついていません。
だから配位結合というのはくっついてしまうと
どこが共有でどこが配位かが見分けがつかなくなってしまいます。
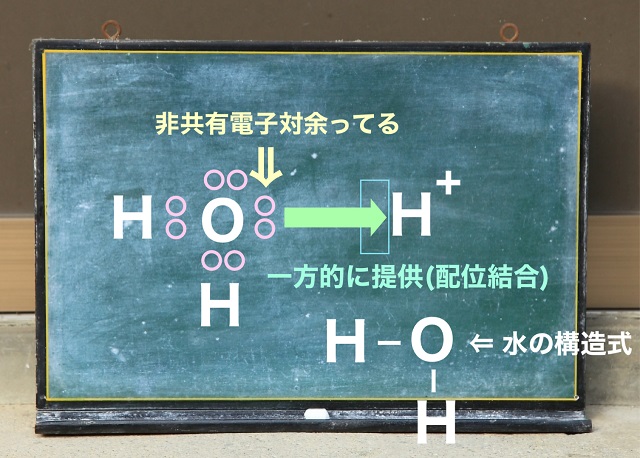
また水については構造式で書くと
上記図のようになります。
ここまでの解説でなぜオキソニウムイオンの電子式に
+が必要なのか疑問が解けたと思います。
不対電子を持っていない$H^{+} $と水が配位結合するから
全体を見たらプラス1になっているからです。
以上で解説を終わります。