今回の記事ではブレンステッドローリーとアレニウスによる
酸・塩基の定義についてわかりやすく解説します。
ただ、いきなり結論だと理解しにくいと思いますので
先に価数について解説しますね。
Contents
ブレンステッドローリーとアレニウスによる酸・塩基の定義
酸と塩基
酸性、中性、アルカリ性(塩基性)って
小学校中学校くらいで聞いたことがあるかなと思います。
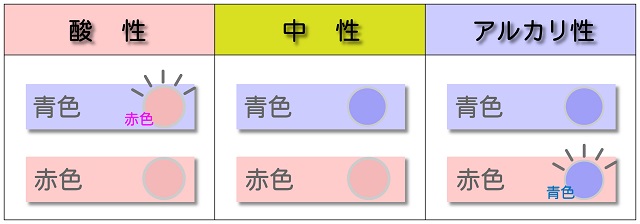
酸性だったら青リトマスが赤になります。
アルカリ性(塩基性)は赤リトマスを青に変えます。
⇒アルカリと塩基の違いをわかりやすく解説
中学くらいでリトマスの色の変化を覚えた方が多いと思います。
また酸の種類にもよりますが、
金属を溶かすことが多くなってきます。
またアルカリ性、塩基性というとその酸の性質を打ち消すとか
また、酸性のものというのは薄めて舐めると酸っぱかったり
塩基性を示すものについては相当薄めないと危険ですが、
相当薄めて舐めれば苦かったりと
漠然と性質がわかっていたわけです。
これをきっちり定義しようということでアレニウスです。
これがアレニウスの定義になります。
アレニウスの定義
アレニウスさんは酸というのは水の中で電離して
水素イオン($H^{+} $)を放出する物質のことだと定義しました。
これに対して塩基というものは水の中で電離して
$OH^{ー} $(水酸化物イオン)を放出する物質だとアレニウスは定義しました。
電離とは水の中で陽イオンと陰イオンに分かれていくことです。
⇒電離度の求め方(公式を利用した方法)
あなたは酸にどんなものがあるか、ご存じですか?
塩化水素($HCl $)を水に溶かせば
塩化水素の水溶液である塩酸になります。
ちなみに塩酸は$HCl $(塩化水素)という化合物と$H_2O $(水)という化合物が混ざった混合物です。
⇒塩酸が混合物である理由(塩酸と塩化水素の違い)
ということで塩酸というのは塩化水素という気体を水に溶かした水溶液です。
このことを別の視点で考えると
塩化水素を水に溶かせば電離して$H^{+} $と$Cl^{ー} $に分かれます。
ここで、$H^{+} $が出ていることがわかりますね。
ということでアレニウスの定義より『酸』だとわかりました。
これに対して水酸化ナトリウム。
水酸化ナトリウムの化学式は$NaOH $です。
$NaOH $は水の中で$Na^{+} $(ナトリウムイオン)と$OH^{ー} $(水酸化物イオン)を
放出するので、アレニウスの定義より塩基性を示すことがわかります。
塩酸とか水酸化ナトリウムは後で解説しますが、
強い酸(強酸)、強い塩基(強塩基)といいます。
特に問題の中に
ヒントがあったり指定があったりしなければ
塩酸や水酸化ナトリウムのような強酸や強塩基は
その電離の様子は以下のように通常一方通行の矢印で書きます。
$NaOH $⇒$Na^{+} $+$OH^{ー} $
$HCl $⇒$H^{+} $+$Cl^{ー} $
ということです。
あえて指定があってこだわってちょっといったり来たりで書くような感じでなければ
通常塩酸や水酸化ナトリウムのような強酸、強塩基の場合は
その電離の様子は一方通行の矢印で書くということを知っておきましょう。
また、酸が電離して生じる水素イオン($H^{+} $)というのは
実際は水の中で水中の水分子と配位結合を形成します。
⇒配位結合とは?例を挙げながらわかりやすく解説
つまり、水と$H^{+} $がくっついて$H_3O^{+} $として存在しています。
この$H_3O^{+} $のことをオキソニウムイオンといいます。
オキソニウムイオンという名前は覚えておいて損はないと思います。
$H^{+} $+$H_2O $⇒$H_3O^{+} $
また、結合についても見直しておいた方がよいかもしれません。
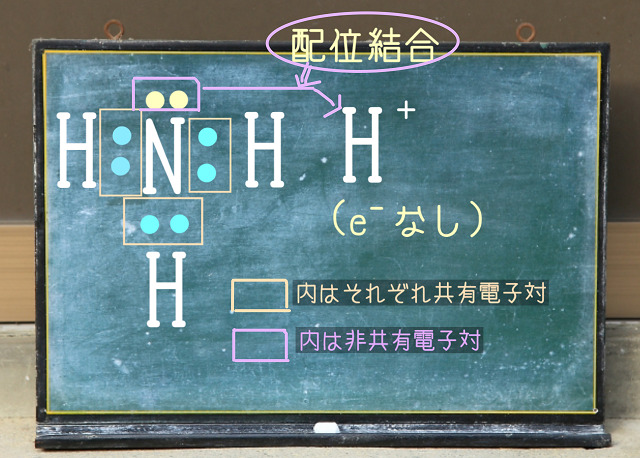
また$H_2O $(水)の非共有電子対が$H^{+} $(水素イオン)と配位結合して
できあがったオキソニウムイオン($H_3O^{+} $)。
オキソニウムイオンは3か所の結合のうちの2か所が共有結合で
1か所が配位結合になっていました。
くっついてしまうと配位結合と共有結合は見分けがつかなくなるという解説を
以前の記事で解説していますので、そちらも復習しておきましょう。
⇒なぜオキソニウムイオンの電子式に+が必要なのか疑問に対する答え
ところでアレニウスの定義は限界があります。
アレニウスは酸は水中で電離して
水素イオン($H^{+} $)を放出する物質のこと
です。
こんな感じでアレニウスの定義には『水中』という限定用語がついてます。
でも、空気中でも酸と塩基の反応が起こるということがわかってきました。
また、アンモニア($NH_3 $)などは化学式を見るだけだと$OH^{ー} $は
出てこなさそうですよね。
でも、アンモニア($NH_3 $)を水に溶かしたアンモニア水は
赤リトマスを青に変えます。
アンモニアがアレニウスの定義では
塩基と説明しにくい。
また水中という限定用語では空気中の酸と塩基の話も説明がつかなくなってくる。
ということでアレニウスの定義では酸と塩基の定義が狭すぎるので
もう少し広く考えようということで出てきたのが、
ブレンステッドとローリーという人です。
これをブレンステッドローリーの定義というのですが、
通常はローリーを省いてブレンステッドの定義と呼ぶことが多いです。
ブレンステッドの定義
ブレンステッドは酸というものは水中という限定用語をくっつけると
説明しにくいので、空気中の反応もあるので
$H^{+} $を相手に渡すものと定義しました。
『$H^{+} $を相手に渡すもの』を専門用語で$H^{+} $供与体といいます。
ブレンステッドは$H^{+} $を渡すものを酸としたわけです。
これに対して塩基というものも
アレニウスの定義にあった水中という限定用語はとって
$H^{+} $のやり取りだけで定義します。
具体的には$H^{+} $受容体がブレンステッドの定義における塩基になります。
酸・・・$H^{+} $供与体
塩基・・・$H^{+} $受容体
ということです。
ブレンステッドの定義だととアレニウスの定義では説明しにくかった
$NH_3 $(アンモニア)の説明がしやすくなります。
アンモニアを水に溶かせばアンモニア水になります。
アンモニアはこちらの記事で解説したように非共有電子対が余っています。
⇒化学結合の種類についてわかりやすく解説
そして水はアンモニアのNの非共有電子対に向かって水素イオンを投げます。
アンモニアは水素イオンを受け取って$NH_4^{+} $(アンモニウムイオン)ができます。
$H_2O $から$H^{+} $が飛べば、
残りは$OH^{ー} $になります。
よって、
$NH_3 $+$H_2O $⇒$NH_4^{+} $+$OH^{ー} $
となります。
上記反応式は$NH_3 $が$H_2O $に溶けて
アンモニア水となって電離していることを表しています。
アンモニアは後で解説しますが、弱塩基(弱い塩基)です。
弱い塩基とか弱い酸は特に問題文などに指定がなければ
弱い酸や弱い塩基は可逆性(行ったり来たりという意味)です。
なので行ったり来たりの矢印でその電離の様子を表します。
そうすると、
$NH_3 $+$H_2O $⇔$NH_4^{+} $+$OH^{ー} $
となりますね。
そうするとアンモニアは水から$H^{+} $を受け取っていますから、
ブレンステッドの定義から塩基だときっちり説明することができます。
そして水は$H^{+} $を渡している(供与している)から酸だといえます。
また、行ったり来たりの可逆ですから、右から左への反応を考えてあげると
$NH_4^{+} $から$OH^{ー} $に向かって$NH_4^{+} $の$H^{+} $が飛べば
$NH_3 $になりますし、$OH^{ー} $が$H^{+} $をもらえば$H_2O $になります。
ということで、$NH_4^{+} $は$H^{+} $供与体だから酸だといえますし、
$OH^{ー} $は$H^{+} $を受け取っていますから、塩基だとわかります。
$NH_3 $+$H_2O $⇔$NH_4^{+} $+$OH^{ー} $
こんな感じでブレンステッドの定義により左から右も右から左も
酸と塩基を定義することができるようになりました。
空気中の反応でもうまく説明がつくようになりましたね。
これで酸と塩基の定義がきっちりできるようになったわけです。
価数と強弱の関係とは?
酸塩基を理解しようと思ったら価数と強弱についての理解はマストです。
まず塩酸($HCl $)から。
先ほど解説したように塩化水素を水に溶かしたら電離して
$HCl $⇒$H^{+} $+$Cl^{ー} $
となりますね。
ややこしい話かもしれませんが
同じ$HCl $であっても塩化水素の水溶液を塩酸といいます。
塩化水素を水に溶かすと塩酸ができるってことです。
で、$HCl $が水に溶けると電離して$H^{+} $(水素イオン)を出します。
電離についてはこちらの記事で解説しています。
・電離度の求め方(公式を利用した方法)
この$H^{+} $(水素イオン)が酸性の原料です。
おそらくあなたも塩酸は酸性だということを知っていると思います。
なので、「???」とはならないでしょう。
ところで
$HCl $⇒$H^{+} $+$Cl^{ー} $
は塩酸は$HCl $から$H^{+} $(水素イオン)が1個出るので1価です。
1価などの価数についてはこちらで詳しく解説しています。
・価数とは?わかりやすく解説【化学】
そして塩酸は$HCl $は強酸です。
これは知っている方が多いでしょう。
強酸とか弱酸の違いがわからない方はこちらをご覧ください。
・酸と塩基の強弱って何が違う?
つまり、塩酸($HCl $)といったら1価の強酸だと表現できます。
次に$H_2SO_4 $(硫酸)について考えてみましょう。
$H_2SO_4 $⇒$2H^{+} $+$SO_4^{2ー} $
水素イオン$2H^{+} $が出ていますね。
ですから酸性です。
しかも2つ水素イオンが出ているので2価です。
2価なので1価の2倍の働きができると考えると理解しやすいでしょう。
価数についてはこちらで詳しく解説しています。
・価数とは?わかりやすく解説【化学】
もちろん硫酸は強酸です。
なので$H_2SO_4 $(硫酸)は2価の強酸ということができます。
こんな感じで1つ1つ酸や塩基に対して価数や強いか弱いか
調べて覚えておくと、あとの学習が楽になってきますよ。
次に$NaOH $(水酸化ナトリウム)についてみていきましょう。
$NaOH $(水酸化ナトリウム)も水に溶かすと電離します。
$NaOH $⇒$Na^{+} $+$OH^{ー} $
電離して$Na^{+} $(ナトリウムイオン)と$OH^{ー} $(水酸化物イオン)がでます。
$OH^{ー} $が塩基性(アルカリ性)のもとです。
$NaOH $(水酸化ナトリウム)の価数は1価の強塩基(強アルカリ)です。
電離についてはこちらの記事で解説しています。
・電離度の求め方(公式を利用した方法)
それから塩基とアルカリの違いについてはこちらで解説しています。
・アルカリと塩基の違いをわかりやすく解説
次に$CH_3COOH $(酢酸)はどうでしょう?
酢酸は有機化合物なので、ちょっとややこしいです。
$CH_3COOH $⇔$CH_3COO^{-} $(酢酸イオン)+$H^{+} $(水素イオン)
酢酸は酢酸イオンと水素イオンに電離します。
酢酸の場合、$H^{+} $(水素イオン)が出ているので酸性だとわかりますね。
ちなみに$CH_3COO^{-} $(酢酸イオン)についている水素(H)はとれません。
$CH_3COOH $で電離するのは右端の水素(H)だけです。
だから$H^{+} $(水素イオン)1個しか電離しません。
なので$CH_3COOH $(酢酸)は1価です。
そして酢酸はお酢として私たちが飲むものでもあるので
強酸なわけがありません。弱酸です。
よって$CH_3COOH $(酢酸)は1価の弱酸です。
$CH_3COOH $⇔$CH_3COO^{-} $(酢酸イオン)+$H^{+} $(水素イオン)
酢酸が弱酸だというのは上記式の⇔(矢印)に現れています。
『⇔』は平衡(化学平衡)です。
化学平衡についてはこちらの記事で解説しています。
・化学平衡についてわかりやすく解説
$CH_3COOH $が一度、$CH_3COO^{-} $(酢酸イオン)+$H^{+} $(水素イオン)になりますが、
元の$CH_3COOH $に戻ってしまうのです。
だから『⇔』になります。
たとえば100個の$CH_3COOH $が$CH_3COO^{-} $(酢酸イオン)+$H^{+} $(水素イオン)になっても、
残り99個は元の$CH_3COOH $に戻ってしまうくらいのイメージです。
つまり、1%しか電離しないってことです。
なので、$H^{+} $(水素イオン)がほとんどできないため酢酸は弱酸なのです。
それから、$NH_3 $+$H_2O $(アンモニア水)について考えてみましょう。
アンモニア水とは$NH_3 $(アンモニア)を水に溶かしたもののことです。
$NH_3 $+$H_2O $⇔$NH_4^{+} $+$OH^{ー} $
$NH_3 $(アンモニア)は$H_2O $(水)と反応すると
$OH^{ー} $(水酸化物イオン)を出します。
$OH^{ー} $(水酸化物イオン)は塩基性で1個しかありません。
なので価数は1です。
なので1価です。
そしてアンモニア水は弱いです。
なので1価の弱塩基です。
ちなみに私は獣医師として日々、犬や猫の治療をしています。
⇒当ブログ管理人のプロフィール
もし犬や猫がアリに噛まれて腫れた場合には
アンモニア水を処方して患部に塗ってもらうことがあります。
実際アンモニア水の効果効能には『虫刺され』が記載されています。
⇒【送料無料】【第3類医薬品】 アンモニア水(P) 500ml×5個セット
アリなどの一部の虫が犬や猫を噛んだり刺したりするときに、
ギ酸という酸を出します。
ギ酸を中和するためにアンモニア水という弱塩基を利用するわけですね。
とにかくアンモニア水は皮膚に塗る薬でもあるくらいなので
強アルカリ(強塩基)なわけがありませんね。
そこからもアンモニア水が弱塩基であることがわかりますね。
よってアンモニア水は1価の弱塩基です。
また、
$NH_3 $+$H_2O $⇔$NH_4^{+} $+$OH^{ー} $
先ほどと同様式が『⇔』と平衡になっていますね。
アンモニア水が反応して水酸化物イオンになったとしても
またアンモニア水に戻ってしまうわけです。
酢酸と同様、100のアンモニア水のうち1個くらいが水酸化物イオンとして残る程度です。
つまり1%くらいしか電離しません。
なので、$OH^{ー} $が少ないから弱塩基なのです。
ちなみに強酸とか強アルカリとか弱酸とか弱アルカリとか
言ってますが、中和などの項目などで必須なのでよく覚えておきましょう。
また、ブレンステッドローリーとアレニウスを理解するためにも
価数と強弱は必ず理解し代表的なものは覚えておきましょう。
中和とは?(ブレンステッドローリーとアレニウスを理解する大前提)
中和とは酸と塩基がぶつかってお互いが打ち消し合うことをいいます。
中和に関する詳しい解説はこちらでもしています。
・中和反応とは?簡単にわかりやすく解説
たとえば
$H^{+} $+$OH^{ー} $
はどんな反応をするでしょう?
プラスの$H^{+} $とマイナスの$OH^{ー} $が反応するので
お互い電荷を打ち消し合います。
結果、イオンではなくなり、水になってしまいます。
よって
$H^{+} $+$OH^{ー} $⇒$H_2O $(水)
となります。
これが中和です。
言葉で表すと水素イオンと水酸化物イオンがぶつかって
お互いに打ち消し合って水になってしまった、これが中和です。
ちなみに$H^{+} $が酸で$OH^{ー} $が塩基(アルカリ)なので
中和のことがよくわかったと思います。
こんな感じで中和というのは$H^{+} $(水素イオン)と$OH^{ー} $(水酸化物イオン)が
お互いに打ち消し合って水になってしまう反応のことです。
まとめ
ここまでの内容がわかったら
ブレンステッドローリーとアレニウスによる酸・塩基の定義は
すんなりと頭の中に入ってくると思います。
まずアレニウスによる酸・塩基の定義から。
・$H^{+} $(水素イオン)を出す物質を酸
・$OH^{ー} $(水酸化物イオン)を出す物質を塩基
としました。
ここまでの解説で価数と強酸とか強塩基みたいな解説をしたので
なんとなくわかると思います。
上記はアレニウスさんが発表した酸、塩基の定義です。
ただ酸、塩基の定義は1つだけではありません。
アレニウスの定義に対して「本当にそうか?」みたいな疑問を投げかけ
新たに酸、塩基の定義を発表した人がいました。
それがブレンステッドさんとローリーさんです。
先にブレンステッドさんが発表し、ローリーさんが後に加勢した形です。
ブレンステッドさんは「アレニウスの定義は狭すぎる」と酸、塩基の定義が変わりました。
アレニウスの定義よりももっと進化した形になったんですね。
・$H^{+} $(水素イオン)を出す物質を酸
・$H^{+} $(水素イオン)を受け取る物質を塩基
ブレンステッドとアレニウスの共通点はどちらも
酸は$H^{+} $(水素イオン)を出す物質という点です。
・アレニウスは$OH^{ー} $(水酸化物イオン)を出す物質を塩基
・ブレンステッドは$H^{+} $(水素イオン)を受け取る物質を塩基
という点です。
なので、ブレンステッドとアレニウスでは塩基の定義の仕方が違うということですね。
ブレンステッドによる酸と塩基の定義は
$H^{+} $(水素イオン)のキャッチボールであると考えました。
酸の反対が塩基だということです。
だから$H^{+} $(水素イオン)を出すのが酸だったら
$H^{+} $(水素イオン)を受け取るのが塩基だと考えたのがブレンステッドです。
たとえば、
$NH_3 $+$H_2O $⇔$NH_4^{+} $+$OH^{ー} $
$NH_3 $は$NH_4^{+} $になってますね。
$H^{+} $をもらってますね。
だから$NH_4^{+} $と水素が4個になっているわけです。
ということは$H^{+} $(水素イオン)を受け取っているので
ブレンステッドの定義によると塩基だということができますね。
それから右辺にある$OH^{ー} $ですが、
左辺に戻ると$H_2O $(水)になりますね。
明らかに右辺の$OH^{ー} $はアンモニアにはなりませんよね。
$OH^{ー} $が$H^{+} $をもらって$H_2O $になっていると
考えることができますね。
つまり、$OH^{ー} $は$H^{+} $を受け取って水になるから
$OH^{ー} $は塩基だということができますね。
$NH_3 $+$H_2O $⇔$NH_4^{+} $+$OH^{ー} $
それから$NH_4^{+} $(アンモニウムイオン)は
逆反応で$NH_3 $(アンモニア)に戻りますね。
$NH_4^{+} $が$H^{+} $を出して$NH_3 $になっていますね。
だから$NH_4^{+} $は酸だということです。
逆反応の意味についてはこちらで解説しています。
・化学平衡についてわかりやすく解説
それから左辺の$H_2O $は右辺に行くと$OH^{ー} $になりますね。
$OH^{ー} $になるときに$H_2O $は$H^{+} $を出していますね。
それで帳尻があいますからね。
ということは$H_2O $は本来なら中性ですが、
ブレンステッドの定義だと酸だということですね。
こんな感じで実際(水は中性だという事)と定義(水が酸になってしまったこと)は別です。
こういう矛盾は化学を勉強していたらよく出るので、あまり悩まないでくださいね。
実際に何性かと定義による酸塩基は別の話だということでした。
以上で解説を終わります。















