今回の記事では化学平衡とは何か?
理解しやすいようにわかりやすい説明を心がけながら解説していきますね。
まず化学平衡を理解する大前提となる反応速度から解説していきます。
Contents
化学平衡をについてわかりやすく解説まとめ
いきなりこの記事のまとめから書きます。
今回の記事はかなり長くなるため、結論だけ知りたい人にとっては
うっとうしい記事になりそうだからです。
ではまとめていきますよ。
まとめを読んでもわからない場合は、
下の方に詳しく解説を書いてますので、ぜひご覧ください。
化学平衡をについてわかりやすく解説まとめ|反応速度
$H_2 $+$I_2 $(気体)⇔$2HI $
(可逆反応)
反応速度は右向きの反応にも左向きの反応にも存在する。
(1)温度を高くする
(2)濃度を高くする
(3)触媒
の3つです。
反応速度は原料濃度に比例する。
そのため以下の式が成り立つ。
$V_1 $(正反応)=$k_1 $【$H_2 $】【$I_2 $】
$V_2 $(逆反応)=$k_2 $【$HI $$】^{2} $
化学平衡とは?
$H_2 $+$I_2 $(気体)⇔$2HI $
(可逆反応)

反応は$V_1 $と$V_2 $がちょうど釣り合ったところで止まります。
これが化学平衡です。
(よくわからない方は、記事の下の方に詳しく理由を書いていますので
ぜひご覧ください)
$V_1 $(正反応)=$V_2 $(逆反応)。
つまり、正反応と逆反応の反応速度が等しいこと。
見かけ上反応が静止している。
です。
正反応は右向き、逆反応は左向きですが、
スピードは同じですから全体としては止まったように見えます。
でも本当に止まっているわけではありません。
$V_1 $と$V_2 $は0ではありませんからね。
実際には動いています。
でも、速度は同じなので全体としては見かけ上、止まったように見えるのです。
化学平衡を理解する大前提となる反応速度とは?
まずこちらの式をご覧ください。
$H_2 $+$I_2 $(気体)⇔$2HI $
水素とヨウ素が反応してヨウ化水素ができるということを表しています。
ところでヨウ素って普通固体です。
ヨウ素
化学式I2
黒紫色、常温で固体
昇華性を持つ(受験生並感)— 不死身のアシュレイ (@ashley_047) November 16, 2019
ヨウ素は通常固体ですが、
上記式では500℃くらいを想定しています。
なので、上記式におけるヨウ素は昇華して気体です。
また、水素もヨウ化水素も気体です。
昇華についてはこちらの記事で詳しく解説しています。
・状態変化とは?図を使ってわかりやすく解説
化学の学習にでも活かしてbyコンビニ
ヨウ素ってさ、うがい薬に使われてんじゃん?じつは固体で昇華性もってるんだって!結構多くの有機溶媒に溶けるみてーだな…
でも水には溶けない、そんな物質。— コンビニおにぎり@配信垢になったかもしれない (@ConvenientRice) September 2, 2020
$H_2 $+$I_2 $(気体)←$2HI $
(左向きの反応)
ところでこの記事で解説する反応は左向きもあります。
$H_2 $+$I_2 $(気体)⇒$2HI $
(右向きの反応、普段の授業ではこちらが多い)
大体の反応って右向きだけですよね。
$H_2 $+$I_2 $(気体)⇔$2HI $
(可逆反応)
でも今回の記事では左向きも右向きもあります。
これを可逆反応といいます。
今回解説する化学平衡は可逆反応の理解が大前提となりますので
知っておいてくださいね。
化学平衡の前提となる反応速度は反応『速度』です。
右向きの反応にも左向きの反応にも速度があります。
ここで
$H_2 $+$I_2 $(気体)⇒$2HI $
(右向きの反応速度を$V_1 $とする)
また、
$H_2 $+$I_2 $(気体)←$2HI $
(左向きの反応速度を$V_2 $とする)
ということで右向きの反応速度をV1、左向きの反応速度をV2としましょう。
・左向きの反応を$V_1 $・・・正反応
・右向きの反応を$V_2 $・・・逆反応
といいます。
そして正反応$V_1 $=$k_1 $【$H_2 $】【$I_2 $】
となります。
(【】はモル濃度で単位はmol/L)
右向きも左向きも原料で反応速度は決まります。
右向きの原料は$H_2 $と$I_2 $なので、
$V_1 $(正反応)=$k_1 $【$H_2 $】【$I_2 $】
という式になります。
上記式は$H_2 $と$I_2 $は水素のモル濃度とヨウ素のモル濃度の積(掛け算)で表されるという事を意味します。
でもどうして$H_2 $+$I_2 $という足し算が
ヨウ素のモル濃度の積(掛け算)で表されるのでしょう?
反応速度というのは指数対数の関係にあります。
対数(log)のことがわかる人なら
なんとなくわかると思いますが、
例えば$log_{ 2 } 3 $+$log_{ 2 } 5 $=$log_{ 2 } 3×5 $
=$log_{ 2 } 15 $
と足し算が見事に掛け算になっていますよね。
これを反応速度では応用しています。
それから逆反応は原料は右辺の$2HI $となるので
$V_2 $(逆反応)=$k_2 $【$HI $$】^{2} $
となります。
こちらも$HI $が2つという足し算が【$HI $$】^{2} $という掛け算になっていますよね。
$HI $+$HI $=$2HI $という足し算から
$HI $×$HI $=【$HI $$】^{2} $という掛け算になってますね。
ちなみになぜ原料で決まるのでしょう?
原料が0だったら反応速度(スピード)は0でしょう。
原料が0なら反応するものがないからです。
このことがわかれば反応速度は原料濃度に比例するという
以下の式は当然ですね。
$V_1 $(正反応)=$k_1 $【$H_2 $】【$I_2 $】
$V_2 $(逆反応)=$k_2 $【$HI $$】^{2} $
反応速度を変化させる3条件とは?
ところで反応速度を変化させる条件が3つあります。
(1)温度を高くする
(2)濃度を高くする
(3)触媒
の3つです。
反応速度を変化させる条件についてはこちらの記事でも
詳しく解説しています。
・反応速度と温度・濃度・触媒の関係についてわかりやすく解説
今回の記事でも別の視点から詳しく解説しますね。
反応速度を変化させる3条件(1)温度を高くする
温度が高いとどうなるでしょう?
$H_2 $+$I_2 $(気体)⇔$2HI $
(可逆反応)
たとえば、ヨウ化水素ができるときを考えてみましょう。
水素分子とヨウ素分子がぶつかって初めて反応します。
温度が高い分子のと運動エネルギーが大きくなるので、分子のスピードが速くなります。
単にコツンとぶつかっただけでは反応しません。
大きな衝撃でぶつかって初めて初めて反応します。
なので温度が高いとエネルギーの高い分子が増えるので
ヨウ化水素が速くどんどんできます。
したがって反応スピードが上がります。
反応速度を変化させる3条件(2)濃度を高くする

濃度が高くなると混雑してきます。
満員電車と同じです。
分子の数が乗車人数で、濃度が高いというのは電車内にいる乗車人数が多いということです。
濃度が高いと
すぐ隣にヨウ素がいたりするので
バンバン衝突してヨウ化水素ができやすいです。
つまり濃度が高いと混雑しているため分子の衝突回数が増えて
ヨウ化水素がどんどんできます。
そのためスピードも上がります。
反応速度を変化させる3条件(3)触媒
触媒には活性化エネルギーを低下させる作用があります。
どういうことかというと、
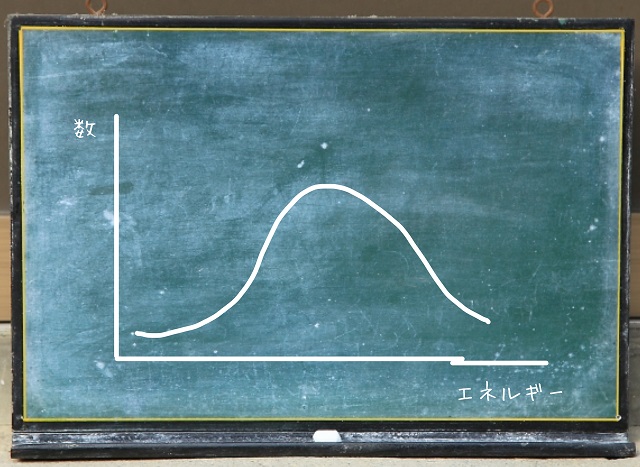
横軸をエネルギー、縦軸を数とすると正規分布しています。
インターネッツに書き込まれたあたかも「みんなの意見」風な発言は,実は正規分布の真ん中ではなく端っこだと思って見てる。 pic.twitter.com/X3zG5A2Kvs
— やき🐐 (@shirajira) June 19, 2022
温度が高いとエネルギーが上がるわけなので
温度で全体のエネルギーが決まるわけです。
でも、人間だってそうですが、
全員同じスピードで歩いたり走ったりしませんよね。
ノソノソ歩く人もいれば猛スピードで走る人もいます。
分子もそうです。
全体のスピードは温度に依存しているかもしれませんが、
個々の分子を見るとみんなバラバラです。
一定の温度でもエネルギーの高い分子もいれば
低い分子もいます。
偏差値のグラフだと考えるとわかりやすいかもしれませんね。
#世の中偏差値40までが8割
とかいうハッシュタグが流れてきたけど、偏差値は平均値を50とした正規分布で、全体の2/3が偏差値40~60の範囲に収まるので、偏差値40以下は約16%しかいないのだが。
真に受けてる人が多いところを見ると、偏差値50(世の中の平均)って思ったほど賢くないんだな。— まさまさ (@masa2ayakou) August 4, 2020
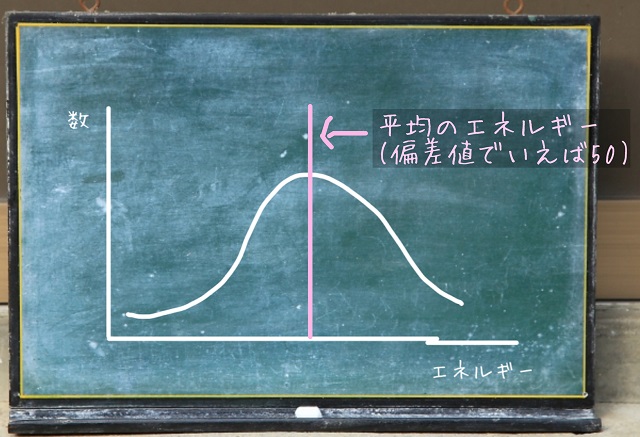
だから上記グラフの線が入ったところが平均のエネルギーで
偏差値なら50みたいな感じですね。
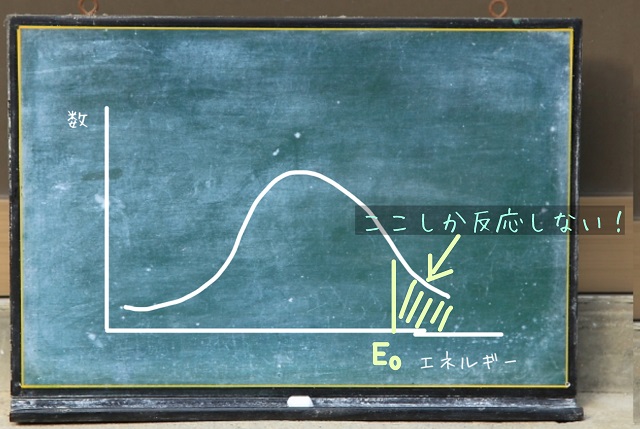
活性化エネルギー($E_0 $)というのは合格ラインだと考えるとわかりやすいかもしれません。
なので、上記画像のところしか反応しません。
この状態だと反応速度は非常に遅いわけです。
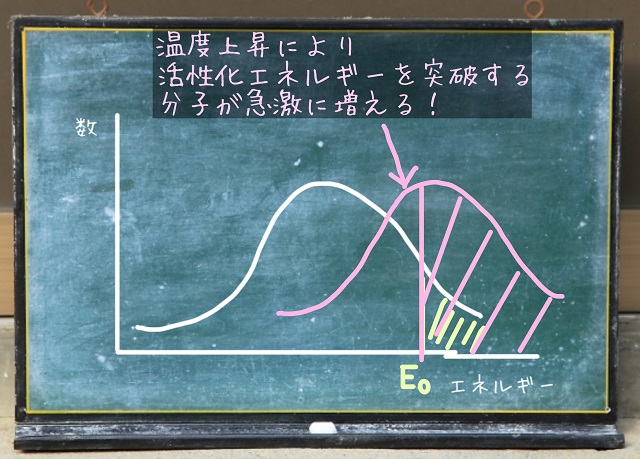
先ほど温度を上げる話をしました。
温度を上げると全体のエネルギーが上がるのでグラフが全体的に右に移動します。
すると活性化エネルギー($E_0 $)を突破する分子は急激に増えますね。
温度を上げる前の面積と比べると圧倒的に広くなっていますね。
つまり何倍にもスピードが上がっていくわけですね。
温度を上げる前よりも多くの分子が反応できるわけですから。
なので温度を高くすると反応速度が上がることはわかりますよね。
では触媒を加えるとどうなるのでしょう?
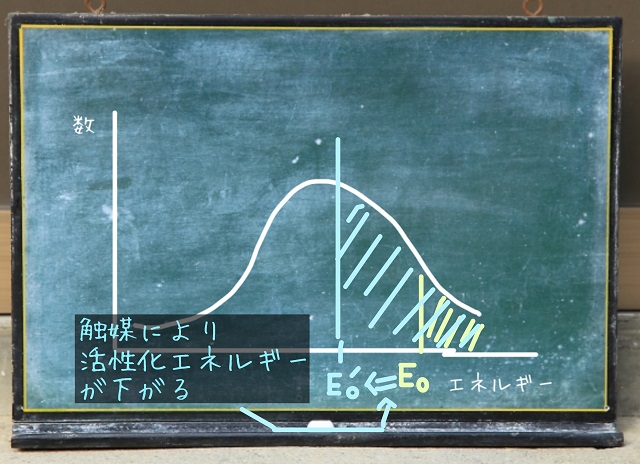
触媒を加えると活性化エネルギー($E_0 $)が$E_0 $´に下がります。
触媒により反応に最低限必要な活性化エネルギーが下がります。
すると温度を上げる前のグラフであっても十分、面積が増えます。
触媒を加えることで活性化エネルギーが$E_0 $から$E_0 $´に下がり
分子が大量に反応するようになります。
結果、反応速度が上がります。
触媒というのは反応を起こすための最低限のエネルギーである
活性化エネルギーを下げる作用があります。
つまり、活性化エネルギーを超える分子数が多いということは
それだけ早く反応するということです。
ここまでを前提知識として化学平衡について解説していきますね。
化学平衡についてわかりやすく説明
ここまでの解説で反応速度も理解できたし、
触媒の事も理解できたことでしょう。
そうなると化学平衡のことが理解しやすくなったはずです。
水素$H_2 $とヨウ素$I_2 $からヨウ化水素$2HI $を作ることを考えましょう。
(可逆反応)
横軸は時間tで縦軸は速度vです。
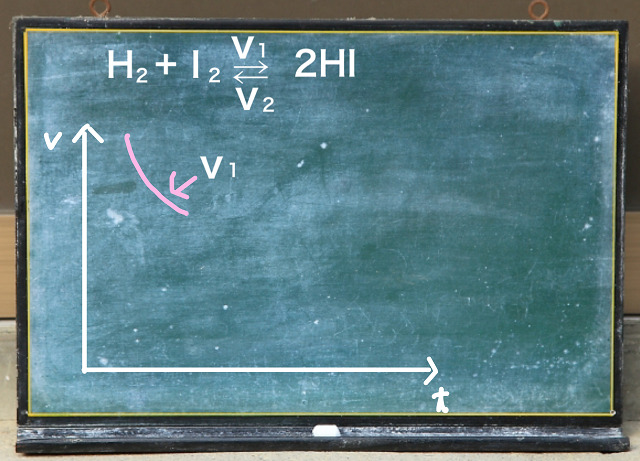
最初に水素とヨウ素を入れておきます。
すると$V_1 $(正反応)というのは最初速いわけですが、
だんだん遅くなります。
なぜなら原料がだんだん減ってくるからです。
最初はたっぷり原料があります。
でも、反応が進んでくると原料が減ってしまいます。
結果、反応が鈍ってきて遅くなっていきます。
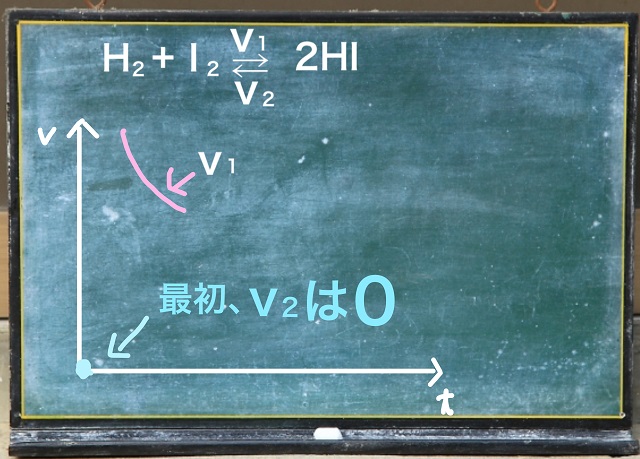
これに対して$V_2 $(逆反応)ですが。
最初は$2HI $(ヨウ化水素)が0です。
水素とヨウ素だけで実験を開始しますから
まだこの段階ではヨウ化水素はありません。
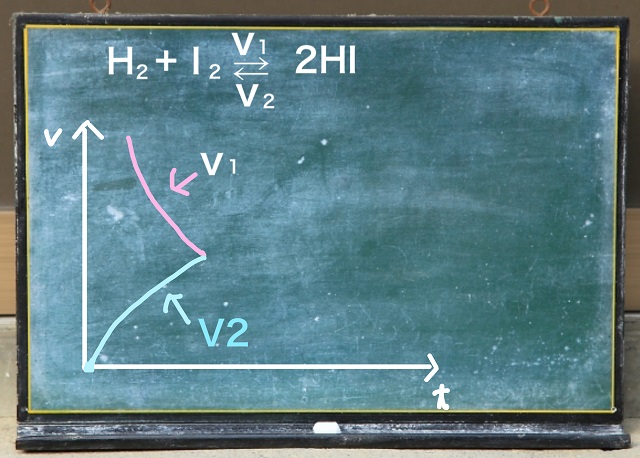
でもヨウ化水素ができあがってくると原料(ヨウ化水素のこと)が増えてきます。
だからだんだんスピードが上がってきます。
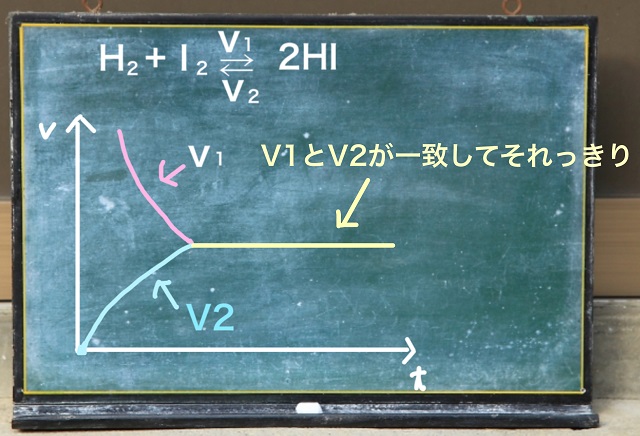
そして$V_1 $と$V_2 $がちょうど釣り合ったところで止まります。
クロスしません。くっついたらそれっきりです。

このくっついた状態を化学平衡といいます。
$V_1 $(正反応)=$V_2 $(逆反応)。
つまり、正反応と逆反応の反応速度が等しいこと。
見かけ上反応が静止している。
です。
正反応は右向き、逆反応は左向きですが、
スピードは同じですから全体としては止まったように見えます。
でも本当に止まっているわけではありません。
$V_1 $と$V_2 $は0ではありませんからね。
実際には動いています。
でも、速度は同じなので全体としては見かけ上、止まったように見えるのです。
以上で化学平衡についての解説を終わります。
わかりやすい解説を心がけましたので
満足していただける方がいたらうれしいです。