今回の記事では電気分解における
電気量の求め方(計算方法)についてわかりやすく解説していきます。
電気分解における電気量の求め方
例題を出しますので、
時ながら電気量について学んでいきましょう。
極板は陽極、陰極ともに白金(Pt)にしておきましょう。
まず上記図の見方がわからない方は前回の記事をご覧ください。
⇒電気分解における陽極の反応の覚え方についてわかりやすく解説
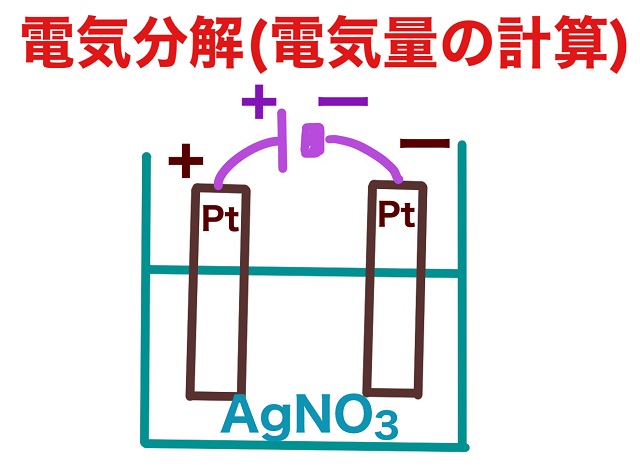
水溶液は硝酸銀($AgNO_3 $)とします。
電気分解したら陰極版(上記図の右側の極板のこと)の質量が4.32g増加したとしましょう。
Ag(銀)の原子量は108とします。
問(1)流れた電気量は何ファラデー(F)?

まずこういう計算問題を解くときであっても
陽極と陰極で何が起こったか?反応式として書けないと何もできません。
なので陽極と陰極の反応式を考えていきましょう。
反応式の書き方は陽極と陰極に分けて別の記事で解説しています。
⇒電気分解における陽極の反応の覚え方についてわかりやすく解説
⇒電気分解陰極の特徴・考え方についてわかりやすく解説
まず陽極から。
極板の白金は電子を出しません。
それから水溶液の$NO_3^{ー} $(硝酸イオン)も電子を出しませんね。
これは前回の記事で解説しています。
⇒電気分解における陽極の反応の覚え方についてわかりやすく解説
なのでこの場合、
水酸化物イオン($OH^{ー} $)が犠牲になって酸素($O_2 $)が発生します。
$4OH^{ー} $⇒$O_2 $+$2H_2O $+$4e^{ー} $
となります。
それから陰極。
陰極の反応式の書き方は以下で解説しています。
⇒電気分解陰極の特徴・考え方についてわかりやすく解説
陰極では硝酸銀水溶液の銀イオンから銀が析出します。
$Ag^{+} $+$e^{ー} $⇒+$Ag $
となります。
すると問題文から、陰極が4.32g増えたとなっているのは
もちろんこれは銀が析出したためです。
銀の原子量は108。
ということは1モル集めると108gになるということです。
⇒1モルから得られる3つの情報とは?わかりやすく解説
1モル(mol)集めて108gということ。
それから陰極は4.32g増えたということ。
これらの情報から、4.32g÷108g=0.04(mol)
$Ag^{+} $+$e^{ー} $⇒+$Ag $
と銀の場合、電子も銀もどちらも係数は1で同じ。
なので、計算して出た0.04molは電子のモル数ということもできますね。
銀のモル数を計算したけど、
陰極の反応式から結局電子のモル数を計算したことにもなるわけです。
では流れた電気量は何ファラデーでしょう?
ここで1ファラデーという単位を覚えましょう。
1ファラデーは電子1モルに相当します。
ここで電子は0.04molでしたから
0.04ファラデー(F)ということです。
これで電気量の計算は終わりです。
問(2)陽極から発生した気体は何モルか?
$4OH^{ー} $⇒$O_2 $+$2H_2O $+$4e^{ー} $
と酸素が発生しますね。
先ほど電子は0.04molだとわかっています。
だって電子は陽極から陰極に流れているだけの話ですから、
電子のモル数は陽極も陰極も同じはずです。
なので、陽極の電子も0.04モルになります。
これも前回の記事を読んでいただければ理解できると思います。
⇒電気分解における陽極の反応の覚え方についてわかりやすく解説
$Ag^{+} $+$e^{ー} $⇒+$Ag $
と陰極の電子は$e^{ー} $で陽極の電子は$4e^{ー} $なので
係数が陰極が1で陽極が4なので違うように思ってしまうかもしれません。
ですが、陽極から出ていく電子と陰極に入ってくる電子は等しいです。
なので惑わされないようにしてください。
$4OH^{ー} $⇒$O_2 $+$2H_2O $+$4e^{ー} $
において$4e^{ー} $が0.04モルということ。
それから$O_2 $の係数は1であることから
$O_2 $のモル数は電子のモル数の4分の1であるから、
発生する酸素のモル数は0.04÷4=0.01モル
ということがわかります。
とにかく陰極の電子も陽極の電子もモル数は同じです。
ただ陽極の場合、周りのメンバーの都合で陽極の電子は4になっているだけです。
あくまで出ていく電子とは言ってくる電子のモル数は同じです。
ここは十分に気をつけてください。
以上で解説を終わります。















