前回の記事でかなり詳しく電気分解の仕組みについてと
陽極での反応について解説しました。
これから解説する記事の内容がよくわからない場合は以下の記事を読んでみてくださいね。
⇒電気分解における陽極の反応の覚え方についてわかりやすく解説
今回の記事では前回の記事を前提にして
電気分解陰極の特徴・考え方についてわかりやすく解説していきます。
電気分解における陰極の反応の特徴
陰極の原則
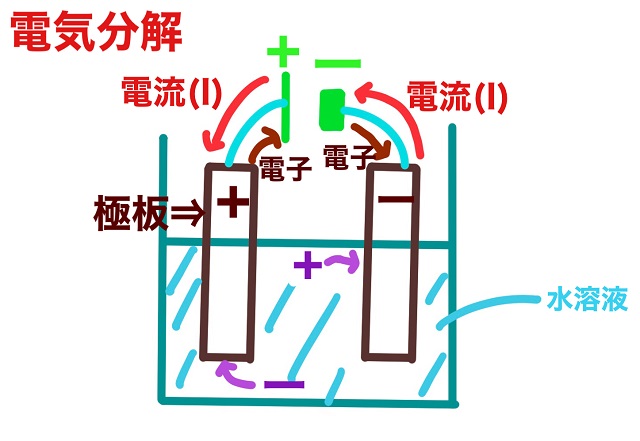
上記図は前回の記事で詳しく解説しています。
よくわからない方はこちらをご覧ください。
⇒電気分解における陽極の反応の覚え方についてわかりやすく解説
陰極(極板のマイナスのこと)は陽極と違ってかなり単純です。
陽極の反応の逆の話ですからね。陽極が理解できたら簡単ですよ。
陰極の方は電子がどんどん入ってきて還元されます。
なので陰極では還元反応が起こっています。
電子が入ってくる=還元される=還元反応
と理解してくださいね。
ところで陽極では極板に注目して反応を考えました。
ですが陰極では極板は考える必要がありません。
どうしてでしょう?
陽極では電子が出ていきました。
電子が出ていくということはもしかしたら極板が溶けてしまうかもしれません。
そういう心配がありました。
ですが陰極は電子がいっぱい入ってきます。
なので陰極では溶ける心配がありませんからね。
むしろ近づいてくる陽イオンをチェックしましょう。

陽極だと極板が電子を出さない場合には
水溶液中の陰イオンが近づいてきました。
陰極では水溶液中の陽イオンが近づいてきます。
陽イオンが電子を受け取ります。
陽イオンというのは一般的には金属イオンです。
金属イオンの特徴って知ってますか?
電気を通す以外に電気陰性度が小さくて価電子が少ないです。
⇒電気陰性度とは?わかりやすく解説
⇒イオン化傾向が大きいほど何がいえるか?
だから電子を気前よく与えます。
電子はマイナスですから自分はプラスになります。
だから金属イオンというのはみんなプラスです。
なので陽イオンといったら基本的に金属イオンです。
たとえば陽イオンとして銅イオンで考えてみましょうか。
$Cu^{2+} $+$2e^{ー} $⇒$Cu $
陽イオンである銅イオンが近づいてきて
陰極には電子が入ってきますから反応します。
結果、金属(銅)になるわけです。
なので陰極に銅がへばりつくということがおこります。
だから陰極って重くなります。
なぜなら銅などの金属が出てくるからです。
出てきた金属が陰極にへばりつくことによって重くなるわけですね。
よって陰極板(マイナスの極板)というのは重くなっている。
なぜなら一般的に金属が電子を受け取って析出してくるからです。
陽極とは大違いですね。
⇒電気分解における陽極の反応の覚え方についてわかりやすく解説
・陽極は極板の金属が溶ける
・陰極は金属が出てきて(析出して)極板にへばりつく
という逆さの関係があります。
陰極の例外
ここまで陰極で起こる原則について解説してきました。
ここからは例外について。
例外としてはイオン化傾向が大きいもの、
たとえば食塩(塩化ナトリウム)のナトリウムイオン($Na^{+} $)、
あるいはカリウムイオン($K^{+} $)、カルシウムイオン($Ca^{2+} $)は
水に溶けます。
これらはイオン化傾向が非常に大きいから水に溶けてしまうのです。
⇒イオン化傾向が大きいほど何がいえるか?
水に溶けた後、アルカリ性になるから
ナトリウムイオン($Na^{+} $)、
あるいはカリウムイオン($K^{+} $)、カルシウムイオン($Ca^{2+} $)は
アルカリ金属とかアルカリ土類金属って言われるんでしたね。
・カリウムイオンとナトリウムイオンはアルカリ金属
・カルシウムイオンはアルカリ土類金属
です。
これらの金属はイオン化傾向が大きいから水に溶けます。
水に溶けるような金属は水溶液中に出てきません。
なぜなら水溶液という水の中ではすぐに溶けてイオンになってしまうからです。
よって、陰極板では
ナトリウムイオン($Na^{+} $)、
あるいはカリウムイオン($K^{+} $)、カルシウムイオン($Ca^{2+} $)は
金属になって出てきません。
仮に万が一金属として析出したって
またすぐに溶けてイオンになってしまいます。
では金属として出てこないとしたら
これらはどうなるのでしょう?
結論として水素($H_2 $)が発生します。
水素が発生するのは結果論です。
前回の記事で解説したように水は
$H_2O $⇔$H^{+} $+$OH^{ー} $
と水溶液がアルカリ性であろうが酸性であろうが電離します。
⇒電気分解における陽極の反応の覚え方についてわかりやすく解説
だから水溶液中には必ず$H^{+} $と$OH^{ー} $は少なからず存在します。
たとえば$Na^{+} $(ナトリウムイオン)ですが
イオン化傾向が大きいですよね。
イオン化傾向が大きいということは電子を出しやすいわけです。
なので電子をナトリウムを貰いにくいです。
ナトリウムが電子をもらうくらいなら
水素イオンがもらうという話になるわけです。
水素の方がナトリウムよりイオン化傾向が小さいですからね。
⇒イオン化傾向が大きいほど何がいえるか?
よって
$2H^{+} $+$2e^{ー} $⇒$H_2 $↑
という反応が起こるわけですね。
こんな感じでイオン化傾向が非常に大きい場合、
あとは塩酸のように水素イオンしかない場合は
$H^{+} $(水素イオン)が$e^{ー} $(電子)をもらって
結果として$H_2 $(水素ガス)が発生するということになります。
・一般的には金属が発生するから陰極板は重くなる
・でも水素イオンしかない時とイオン化傾向が大きい時は
水素が発生する
ということが起こります。
こんな感じで陰極はそんなに覚えることはありません。
なので先に陽極を覚えるようにしましょう。
⇒電気分解における陽極の反応の覚え方についてわかりやすく解説