以前の記事で純物質と単体の違いであったり、純物質と混合物の違いについて解説しました。
⇒単体と化合物の例と単体と純物質の違いをわかりやすく解説
⇒純物質と混合物の違いを例を挙げてわかりやすく解説
今回は化合物と混合物の違いについて解説したいのですが、
その前提として単体の復習をしましょう。
まず周期表をご覧ください。
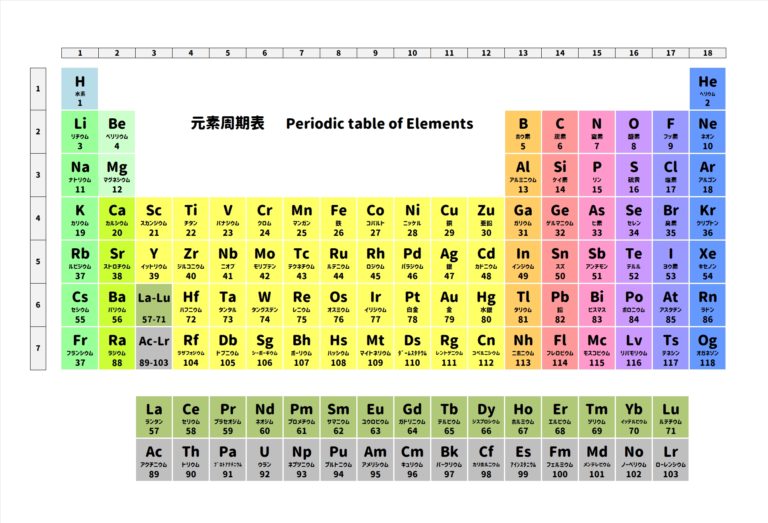
周期表には元素記号がのっていますが、
元素記号1種類だけで作ることができるものを単体といいます。
例を挙げるとすると酸素は元素記号1種類だけで作れるので単体ですし
金(Au)も1種類だけで作れるので単体です。
水素も単体です。
ではここで問題です。
ダイヤモンドは単体ですか?
ダイヤモンドは単体です。
ダイヤモンドという名前で周期表にはのっていませんが、
炭素だけでできています。
だから、ダイヤモンドも単体に該当します。

こんな感じで元素記号1種類だけで書けるものを単体といいます。
これに対して化合物は周期表の元素記号が2種類以上くっついて構成されたものをいいます。
・二酸化炭素($CO_2 $)
・アンモニア($NH_3 $)
・水($H_2O $)
・エタノール(アルコール、お酒)($C_2H_5OH $)
などです。
二酸化炭素は炭素Cと酸素Oが2つくっついてできたものです。
アンモニアは窒素Nと水素H3つがくっついてできたものです。
こんな感じで周期表の元素記号が2種類以上くっついでできたものを化合物といいます。

ここまで純物質の仲間である単体、化合物について説明しました。
次に混合物ですが。
混合物というのは2種類以上の純物質が混ざっているものを指します。
ところで化合物も2種類以上でしたし、混合物も2種類以上。
「化合物も混合物も2種類以上で違いがわからないよ」とよく言われます。
化合物と混合物の違い

化合物と混合物の違いですが、
化合物は2種類以上の周期表の元素記号が
くっつくことによって1つのものになっているものを指します。
これに対して混合物は2種類以上の純物質が混ざっているものを指します。
こんな感じで
くっついているか、混ざっているかで化合物と混合物を分けることができます。
くっつくというのは
その性質がなくなってしまうということです。
水($H_2O $)は周期表の元素記号に入っている水素と酸素が
くっついてできたものです。
くっつくということによって水素や酸素の性質はなくなります。
酸素は呼吸するのに必要ですが、
水($H_2O $)は酸素と水素がくっついてできたものだからといって
この水に酸素の性質はありません。
水の中に入って潜ったら、呼吸はできませんよね。
もっというと、水の中に入って潜って
水を飲んでも、酸素が体内に摂り込まれませんよね。
こんなことは命に関わることなので絶対にしないでくださいね。
こんな感じで元素がくっつくことによって
そのもの自身の性質はなくなります。
あくまで水($H_2O $)の性質になります。
これが化合物です。
これに対して混合物は混ざっている状態です。
たとえば、混合物の具体例として空気を挙げることができます。
空気は窒素($N_2 $)や酸素($O_2 $)などが混ざったものです。
ただ混ざったものなので、空気は窒素や酸素の性質をそれぞれ持っています。
なので、酸素と窒素が混ざり合って全く違う物質ができるわけではありません。
・化合物は元素が2種類以上くっついてできたもの
⇒くっつく前の元素の性質は持っていない
例)水($H_2O $)に酸素の性質や水素の性質はない
・混合物は純物質が2種類以上混ざったもの
⇒混ざっただけなので、もとの純物質の性質を持っている
例)空気(酸素や窒素が混ざってできたもの)
空気は酸素の性質や窒素の性質がある
では理解できたか、問題を出してみますね。
あと、酸化第二鉄はどうでしょう?
周期表に存在する酸素と鉄がくっついたものなので化合物です。
では希硫酸はどうでしょう?
希硫酸は混合物です。
硫酸は化合物です。
ただ希硫酸の希は希釈の希です。
なので水で薄めているので水と硫酸の混合物になります。
最後に海水はどうでしょう?
海水は水と塩化ナトリウムの混合物です。
以上で解説を終わります。















