以前、イオン化傾向を語呂合わせで覚える方法について解説したことがあります。
化学の先生の中には語呂合わせによる暗記方法を毛嫌いする方もいます。
でもそんな先生でもイオン化傾向だけは語呂合わせを推奨していたりします。
それくらいイオン化傾向は暗記ヨウ素が強いわけですね。
ではここからが本題です。
今回の記事ではイオン化傾向が大きいほど何がいえるか?
わかりやすく解説していきたいと思います。
Contents
イオン化傾向が大きいほど何がいえるの?
K>Ca>Na>Mg>Al>Zn(亜鉛)>Fe(鉄)>Ni>Sn(スズ)>Pb(鉛)>($H_2 $)>Cu>Hg>Ag>Pt>Au
貸そうかなまああてにすんなひどすぎる借金
K(貸そう)>Ca(か)>Na(な)
>Mg(ま>Al(あ)>Zn(あ)>Fe(鉄)>Ni(に)>Sn(すん)>Pb(な)
>(H2)(ひ)>Cu(ど)>Hg(す)>Ag(ぎる)>Pt(借))>Au(金)
です。
ということでイオン化傾向は
カリウム(K)、カルシウム(Ca)、ナトリウム(Na)から始まって
最後は白金(Pt)、金(Au)で終わるようになっていますね。
ただ上記イオン化傾向というのは実は代表的なものだけになっています。
実は他にも中にいっぱい存在しているのです。
たとえばLi(リチウム)やCs(セシウム)は
K(カリウム)よりもイオン化傾向が大きいです。
でも、高校化学で学ぶイオン化傾向では出てきません。
こういったのは大学で化学を専門的に学ぶ場合だけ覚えればOKです。
なぜなら大学受験に出ないからです。
話を元に戻しますね。
イオン化傾向とはイオンへのなりやすさのことです。
たとえば高校化学ではイオン化傾向が一番大きいカリウム(K)を
例に考えてみましょう。
K⇒$K^{+} $+$e^{ー} $
という形で電子($e^{ー} $)を失い、
カリウムイオン($K^{+} $)になります。
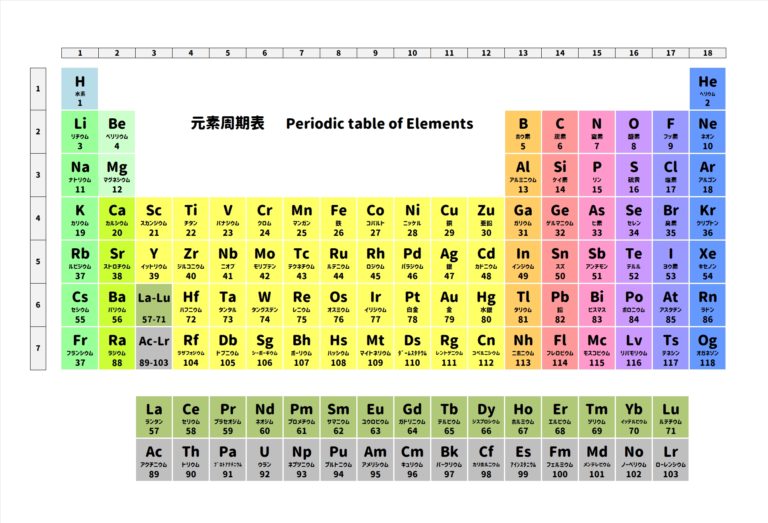
カリウムは周期表を見ると一番左側の1族です。
ということなので価電子は1個です。
なので電子が1個取れたわけですね。
電子配置とかをきちんと暗記しながら勉強していきましょう。

話を元に戻します。
ナトリウムと同じように一番外側に1個だけ電子が飛んでいます。
だからその1個が取れるということです。
K>Ca>Na>Mg>Al>Zn(亜鉛)>Fe(鉄)>Ni>Sn(スズ)>Pb(鉛)>(H2)>Cu>Hg>Ag>Pt>Au
貸そうかなまああてにすんなひどすぎる借金
K(貸そう)>Ca(か)>Na(な)
>Mg(ま>Al(あ)>Zn(あ)>Fe(鉄)>Ni(に)>Sn(すん)>Pb(な)
>(H2)(ひ)>Cu(ど)>Hg(す)>Ag(ぎる)>Pt(借))>Au(金)
このようにしてカリウムからカリウムイオンができるわけです。
そしてカリウムはイオン化傾向が大きいですね。
イオン化傾向が大きいということはどういうことでしょう?
イオン化傾向が大きいということは・・・
カリウムはイオン化傾向が大きいです。
イオン化傾向が大きいということは、
まずイオンになりやすいということがいえます。

ではイオンになりやすいということはどういうことでしょう?
たとえば鉄の釘があるとします。
そして鉄の釘を溶かしたいとしましょう。
どうしたらよいでしょう?
たとえばバケツに水を入れてその中に鉄の釘を入れて
かき混ぜたとしましょう。
これではそう簡単には溶けません。
ではどうすれば溶けるのでしょう?
カリウムで例えると、
K⇒$K^{+} $+$e^{ー} $
上記のようになれば溶けます。
たとえば鉄の釘を塩酸に入れると
水素が発生して溶けていきます。
もちろんこの場合、鉄が鉄イオンになっています。
小学校理科の実験
塩酸にアルミと鉄を溶かして蒸発させたもの
塩酸+アルミニウム→塩化アルミニウム+水素(左)
塩酸+鉄→塩化鉄+水素(右) pic.twitter.com/FylTYStNmv— 獅子@えじぷとLOVE💕 (@HKLion2021) October 14, 2021
つまり金属が水に溶けるときというのは
必ずイオンです。
ということは、イオンになりやすいということは
溶けやすいということです。
金属が水に溶けるときには必ずイオンになるということです。
つまりイオンになりやすいということはそれだけ溶けやすいということです。
それからイオン化傾向が大きいと錆びやすいという特徴もあります。
錆びるとは化学的にはどういうことでしょう?
酸素がくっつくことです。
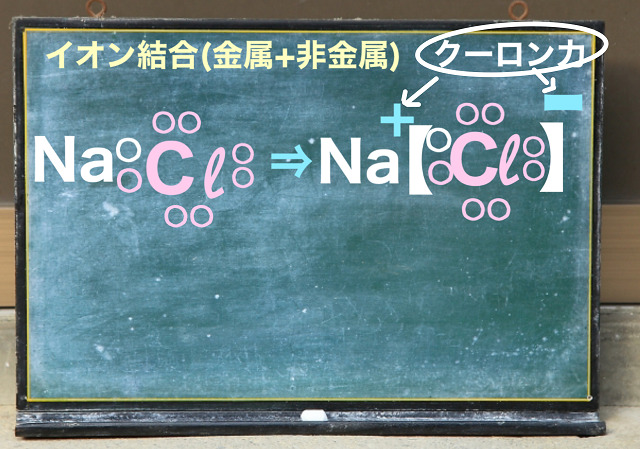
なので金属に酸素という非金属が結合するということなので
イオン結合ということですね。
イオン化傾向が大きいということはイオンになりやすい。
イオンになりやすいということは酸素がくっつきやすいということです。
つまりイオン化傾向が大きいということは錆びやすいということです。
ここまでまとめると
・イオンになりやすい
・溶けやすい
・錆びやすい
ということです。
カリウムとかカルシウムそのものを肉眼で見たことないですよね?
だいたい私たちが見るころにはすでにイオンになっていて溶けていたり
錆びていたりするわけです。
イオン化傾向がカリウムとかカルシウムと比べて
圧倒的に小さい金は違いますよね。
金が溶けたり錆びたりしたら一大事です。
金は全然溶けないし、錆びないですよね。
だから金はイオン化傾向が小さいということがわかります。
イオン化傾向が大きいという知識を利用して化学反応式を組み立ててみる
例えば、亜鉛に希硫酸を加えたとしましょう。
希硫酸=薄い硫酸です。
化学反応式を組み立ててみましょう。
イオン化傾向の知識と酸化還元の知識を組わせて
さらに化学の理解度をアップさせていきましょう!
(1)イオン化傾向を考える
K>Ca>Na>Mg>Al>Zn(亜鉛)>Fe(鉄)>Ni>Sn(スズ)>Pb(鉛)>(H2)>Cu>Hg>Ag>Pt>Au
貸そうかなまああてにすんなひどすぎる借金
K(貸そう)>Ca(か)>Na(な)
>Mg(ま>Al(あ)>Zn(あ)>Fe(鉄)>Ni(に)>Sn(すん)>Pb(な)
>($H_2 $)(ひ)>Cu(ど)>Hg(す)>Ag(ぎる)>Pt(借))>Au(金)
まずイオン化傾向を考えます。
イオン化傾向を考えますと、亜鉛(Zn)の方が水素(H)よりも大きいです。
Zn>H
ということです。
(2)水素は金属でないのにどうしてイオン化傾向の表に掲載されているの?
イオン化傾向の表はたいてい水素Hは(H)とか($H_2 $)とカッコをつけて書いてます。
理由は水素は金属ではないからです。
イオン化傾向の表で水素以外はみんな金属ですからね。
区別するために水素だけ()をつけているわけです。
話を元に戻します。
今回の例は『例えば、亜鉛に希硫酸を加えた』という話でした。
Zn>H
と書いたのは希硫酸の硫酸に水素Hが入っていますよね。
だからZn>Hと書いたのです。
こんな感じで水素Hってイオン化傾向の表にとって必要なものなのです。
水素$H_2 $は金属でないのにどうしてイオン化傾向の表に
掲載されているのか?
理由は希硫酸などの酸というのは$H^{+} $(水素イオン)がからむので
どうしても必要だからです。
なので水素$H^{+} $の位置はとても大事です。
(3)イオン反応式を作る
Zn>H
であることから今回の例では
水素よりも亜鉛の方がイオンになりやすいということがわかるわけです。
よって
$Zn $+$2H^{+} $⇒$Zn^{2+} $+$H_2 $↑
上記式で、$2H^{+} $は酸だからです。
そして$Zn $と$2H^{+} $でイオンになりやすいのはどっちですか?
イオン化傾向より亜鉛Znの方がイオンになりやすいですよね。
「???」となりませんでしたか?
じゃどうして上記式の左辺は$2H^{+} $と水素がイオンになっているのでしょう?
おかしいですよね。
イオンになりやすいのはZnの方であってHではありませんよね。
Znの方がイオンになりやすいから右辺で$Zn^{2+} $と亜鉛イオンに変化するわけですよ。
逆に水素は亜鉛と比べたらイオンになりにくいので
右辺(反応後)で$H_2 $↑と水素ガスに変化するわけです。
亜鉛はイオンだから溶けたわけです。
そして水素ガスが発生しました。
つまり亜鉛に希硫酸を加えると
見た目は亜鉛が溶けて水素ガスが発生したということです。
イオン化傾向で解析をすると
亜鉛の方が水素よりもイオンになりやすい。
そして水素の方がイオンになりにくいからガスとして脱出したわけです。
(4)半反応式
$Zn $+$2H^{+} $⇒$Zn^{2+} $+$H_2 $↑
上記式はイオン反応式です。
これは前回の記事でくどいくらいに解説しています。
⇒酸化還元反応式の作り方についてわかりやすく解説
前回の記事で解説したように
イオン反応式を作る前段階に半反応式が存在するはずです。
実際、
$Zn $+$2H^{+} $⇒$Zn^{2+} $+$H_2 $↑
というイオン反応式にも半反応式が存在します。
酸化剤は水素イオンです。
$2H^{+} $+$2e^{ー} $⇒$H_2 $↑
酸化剤なので電子を奪って水素ガスになっているわけですね。
この辺の話もこちらで解説していますのでご覧ください。
⇒酸化還元反応式の作り方についてわかりやすく解説
そして亜鉛は逆なので還元剤です。
Zn⇒$Zn^{2+} $++$2e^{ー} $
Znがイオンになるということは当然電子を出しているわけです。
だから還元剤です。
Zn⇒$Zn^{2+} $++$2e^{ー} $
$2H^{+} $+$2e^{ー} $⇒$H_2 $↑
の電子を消した結果、イオン反応式である
$Zn $+$2H^{+} $⇒$Zn^{2+} $+$H_2 $↑
が出来上がっていたのです。
ただ、イオン化傾向に関係のある話というのは
半反応式をすっ飛ばしていきなりイオン反応式を導いた方が理解しやすいです。
(5)イオン化傾向と酸化還元反応の話は実はつながっていた!
とはいえ、半反応式が存在するということは
イオン化傾向が酸化還元ということがわかりますよね。
どうしてイオン化傾向が酸化還元なのでしょう?
Zn⇒$Zn^{2+} $++$2e^{ー} $
$2H^{+} $+$2e^{ー} $⇒$H_2 $↑
イオン化傾向によって電子の出し入れをしていますからね。
これは半反応式を見れば明らかです。
なのでイオン化傾向は酸化還元というカテゴリーの中で
解説されるわけですね。
(6)イオン化傾向が大きいということを利用して最後に化学反応式を作る
最後に化学反応式を作りましょう。
亜鉛に希硫酸を加えたという話でしたから、
イオン反応式である
$Zn $+$2H^{+} $⇒$Zn^{2+} $+$H_2 $↑
似大して両辺に$SO_4^{2ー} $(硫酸イオン)を加えましょう。
この辺もこちらの記事で詳しく解説しています。
⇒酸化還元反応式の作り方についてわかりやすく解説
すると、
$Zn $+$H_2SO_4 $⇒$ZnSO_4 $+$H_2 $↑
となります。
上記化学反応式はイオン化傾向がわかれば簡単にできますね。
イオン化傾向は裏を返すと酸化還元で実は電子を受け渡していると
考えると点と点が線で繋がりますね。
こんな感じで亜鉛に希硫酸を加えるというのは
イオン化傾向を使う代表的なものですが
実は酸化還元であって、そして化学反応式はこちらの記事で解説している方法を使えば
誰でも簡単に導けるということです。
⇒酸化還元反応式の作り方についてわかりやすく解説
以上で解説を終わります。