前回の記事では分子間力とは何か、
例を挙げながら解説しました。
⇒分子間力とは?わかりやすく解説
分子間力とはもちろん、分子の間で働く力のことで
別名、ファンデルワールス力です。
以前の記事で化学結合について解説しました。
⇒化学結合の種類についてわかりやすく解説
化学結合というのは原子同士の結合です。
非常に距離が近いので結合力は強いです。
これに対して分子間力は分子と分子の間に働く力であり
分子同士の距離は原子同士の距離より離れています。
だから分子間力は化学結合よりも弱いです。
分子間力は化学結合よりも弱いという理解は
今回解説する分子間力の1つ水素結合の理解する上ですごく重要になります。
分子間力の1つ水素結合の特徴
水素結合と分子間力ってどういう関係があるのでしょう?
水素結合は分子間力の一種です。
水素結合はあくまで分子間に働く力です。
ところで、
水素Hの電気陰性度の値は2.1です。
「電気陰性度って何?」と気になる方はこちらをご覧ください。
⇒電気陰性度とは?わかりやすく解説
これに対してフッ素Fの電気陰性度は4.0です。
ちなみに電気陰性度が4.0というのは最大の値になります。
4.0より大きな数値がないってことです。
・水素の電気陰性度は2.1
・フッ素の電気陰性度は4.0
です。
電気陰性度
☆ハニーでフッ素死んだ
ハ→H
ニー→2.1フッ素→F
死んだ→4.0+α Fから左のBCNOFは4.0から0.5ずつ下がる
↓
F4.0
O3.5
N3.0
C2.5
B2.0— 勉強マン (@vL8oJQPiLIZJ3qR) May 17, 2022
ところで水素とフッ素は共有結合します。
どちらも非金属だからです。
よくわからないという方はこちらをご覧ください。
⇒化学結合の種類についてわかりやすく解説
結果、フッ化水素(HF)ができます。
それから酸素の電気陰性度は3.5です。
水素と酸素が共有結合すると水ができます。
あと窒素の電気陰性度は3.0で水素と共有結合するとアンモニアができます。
水素というのは電気陰性度が2.1で
非金属の仲間と比べると比較的小さいです。
これに対してここまで挙げたフッ素、窒素、酸素の電気陰性度は
水素よりも大きいです。
ということは水素とフッ素、窒素、酸素のどれかが共有結合したら
当然電子はフッ素、窒素、酸素の方に流れますね。
電気陰性度とは電子をひきつける力のことです。
電気陰性度の小さいほうから大きいほうに電子は流れます。
⇒電気陰性度とは?わかりやすく解説
よって、水素はプラスになり、
フッ素、窒素、酸素は電気的にマイナスに偏ることになります。
ここまでまとめると、
水素と比べてフッ素、窒素、酸素との電気陰性度の差が大きいわけです。
電気陰性度の差が大きいということは
水素の方から窒素、フッ素、酸素の方に電子をひきつける力が強いってことです。
結果、電荷が大きく偏ります。
これを化学用語で『大きな極性を持つ』といいます。
極性のことがよくわからない方はこちらの記事をご覧ください。
⇒極性分子とは?簡単にわかりやすく解説
極性=電気の偏りのことですから
極性が大きいということは電気的に引っ張る力が強くなるってことです。
大きな極性を持つとどういうことになるのでしょう?
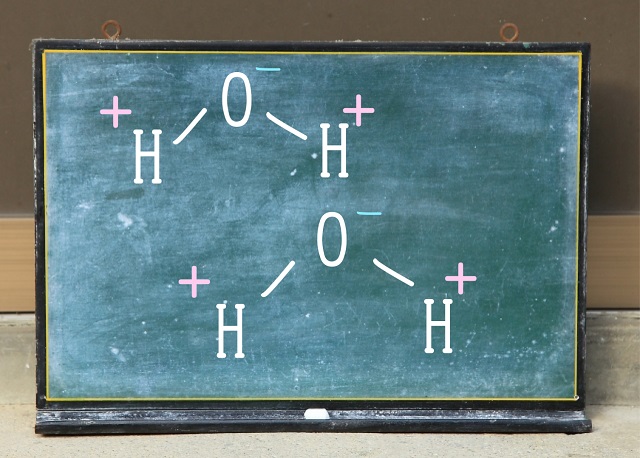
代表的な例は水分子です。
前回の記事で水分子は折れ線型になると説明しましたね。
⇒極性分子とは?簡単にわかりやすく解説
そして酸素はマイナスに水素はプラスになります。
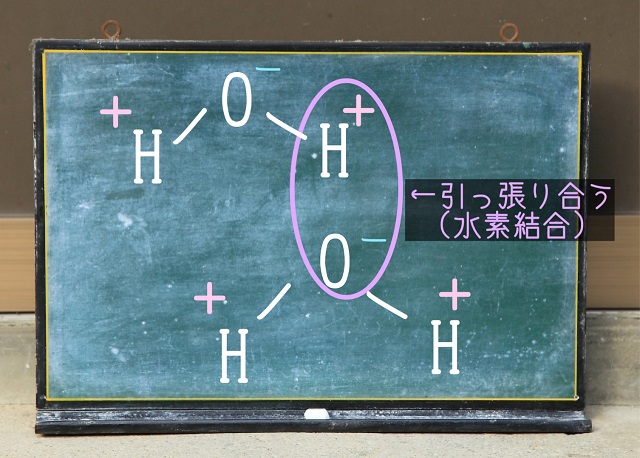
上記図のように水素のプラスと酸素のマイナスで引っ張り合います。
これが水素結合です。
大丈夫ですか?
水分子同士にも通常の分子間力はあります。
これに加えてプラスアルファで水素結合も加わります。
つまり、上記図では『分子間力+水素結合』のパワーが働いているってことです。
ここまで解説してきたように
大きな極性を持つということは分子間に水素結合ができるということです。
水素結合は分子間力に加えてさらにプラスされた結合です。
なので、結合を切るためにはたくさんのエネルギーが必要になりますね。
大丈夫ですか?
ただ分子間力しかない結合よりも分子間力+水素結合でくっついている結合の方が
結合を切るためにエネルギーは大きくなるのは想像できますね。
その結果、融点や沸点が異常に高くなるという特徴が水素結合にはあります。
『異常に』と書いたのは間違いではありません。
想像以上に沸点や融点が高くなるから異常なのです。
まず電気陰性度の差が大きい
⇒極性が大きい
⇒分子間に水素結合ができる
⇒分子間力に加えて水素結合ができるから切るために大量のエネルギーが必要
⇒沸点や融点が異常に高くなる
ということです。
とはいえ、水素結合は化学結合と比べると弱いです。
⇒化学結合の種類についてわかりやすく解説
でも、通常の分子間力(ファンデルワールス力)と比べると水素結合は強いです。
分子間力<水素結合<<化学結合
ということです。
だから水素結合が加わることによって
想像以上に融点や沸点が上がるというこになります。
たとえばハロゲン化水素について考えてみましょう。
ハロゲンは17族です。
フッ素(F)、臭素(Br)、塩素(Cl)、ヨウ素(I)のことですよ。
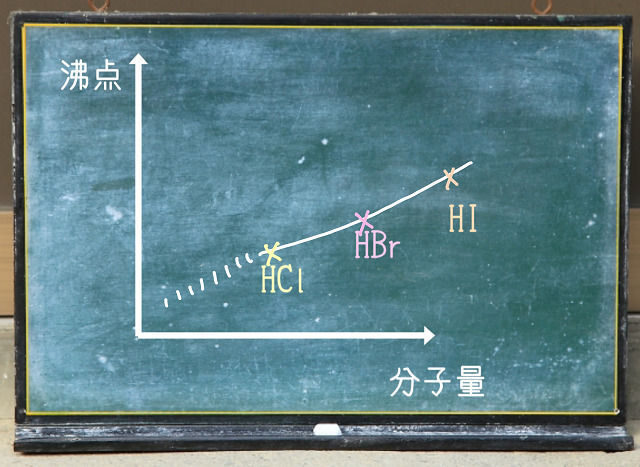
縦軸沸点、横軸を分子量とするグラフを見てみると
塩化水素(HCl)<臭化水素(HBr)<ヨウ化水素(HI)
とだんだんと沸点が上がっていきます。
分子量が増えていくと、つまり重くなると分子間力は強くなります。
なので、切るためによりエネルギーが必要なり
沸点が上がるわけです。
ということは、このペースでグラフの左側に行くと
もっと分子量の小さいHF(フッ化水素)は沸点はもっと下がりそうな気がしますね。
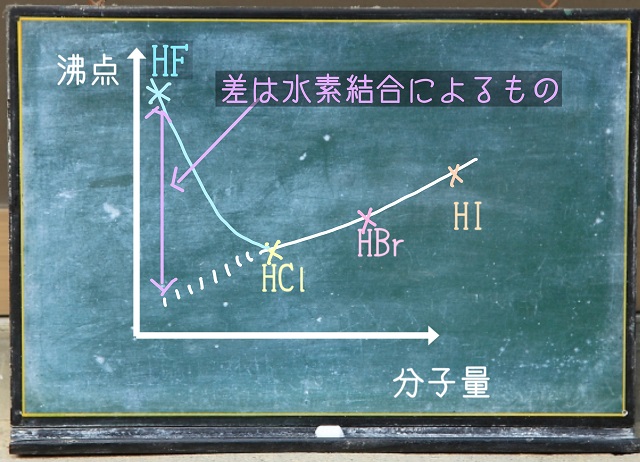
ですが、フッ化水素(HF)の沸点はものすごく高いです。
臭化水素とかヨウ化水素などよりフッ化水素の分子量は小さいですから
フッ化水素の沸点は低いはずです。
でも、フッ化水素の沸点は高いです。
どうしてでしょう?
フッ化水素の場合、分子間力に加えて水素結合が働くからです。
臭化水素や塩化水素、ヨウ化水素は水素結合で結ばれているわけではありません。
水素結合を切るために余計にエネルギーが必要です。
なので、フッ化水素の沸点が臭化水素などよりも上がります。
こんな感じで水素結合は分子間力以上に結合が強いため
水素結合をしているものの沸点や融点は異常に上がるという特徴も
知っておきましょう。
以上で解説を終わります。















