前回の記事では分子間力とはどういう力なのか、
例を挙げながら解説しました。
⇒分子間力とは?わかりやすく解説
では分子間力にはどんなものがあるのでしょう?
大学受験の化学で覚えておかないといけない分子間力は3種類あります。
今回の記事では分子間力の種類について
わかりやすく解説します。
分子間力の種類|水素結合
まず分子間に働く引力の中でもっとも強いもの、
それが水素結合といわれる分子間力です。
水素結合に関する詳しい説明はこちらでしています。
⇒分子間力の1つ水素結合の特徴についてわかりやすく解説
水素結合は分子間力の中でも強い方に分類される結合です。
たとえば水の沸点って100℃ですよね。
水は水素結合をするのですが、ものすごく沸点が高いです。
もし水が水素結合を作らなければ
水の沸点はマイナス90℃くらいといわれています。
マイナス90℃だと海が沸騰してしまい蒸発するから
海は存在できません。
地球に生命が誕生するきっかけとなったのは
水が分子間力という特殊な引力で結びついて沸点が異常に高くなっているからです。
水素結合のおかげで私たちはこの地球上で生きていけるということもできます。
水素結合という分子間力はめちゃくちゃ強いです。
⇒分子間力の1つ水素結合の特徴についてわかりやすく解説
でもどんな分子にも水素結合ができているわけではありません。
分子間力の1つ水素結合を作れる構造には条件があります。
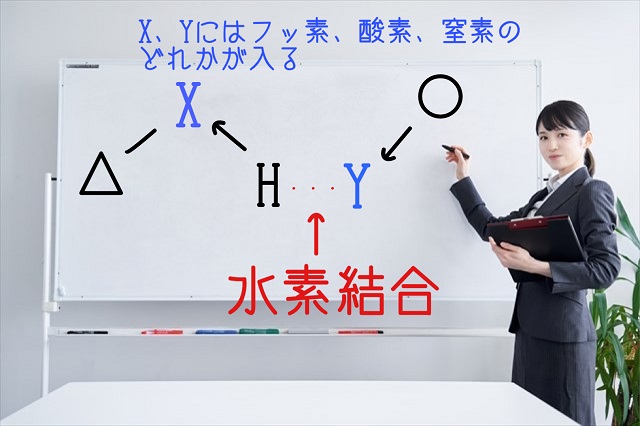
上記図の△と○は何でもOKです。
XとYには条件があります。
このX、Yには大学受験だとフッ素、酸素、窒素のどれかが入ると学びます。
私も獣医大学受験時代はそのように覚えました。
⇒当ブログ管理人のプロフィール
ただ、大学に入ると学部によっては習うと思うのですが、
塩素も水素結合を作ります。
今回の記事では大学受験レベルの化学の解説を目指しているので
X,Yに入るのはフッ素、酸素、窒素のどれかがだという前提で話を進めますね。

電気陰性度とは電子を引き付ける力の強さのこと。
フッ素、酸素、窒素は第2周期で電気陰性度が大きな元素です。
⇒電気陰性度とは?わかりやすく解説
共有電子対を自分の方にひきつける力が強いということは
XやYが自分の方に向かって電子を引き寄せます。
共有電子対についてはこちらの記事で詳しく解説しています。
⇒化学結合の種類についてわかりやすく解説
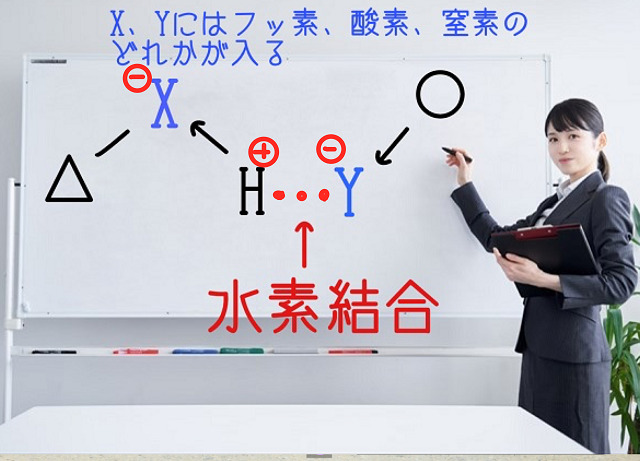
結果、Xと結合している水素Hはプラスの電荷になります。
またXはマイナスの電荷になります。
Yも電気陰性度が大きいので電子を自分の方にひきつけマイナスの電荷になります。
すると、水素HのプラスとYのマイナスの間で引力が働きますね。
プラスとマイナスは引きあいますからね。
これこそが水素結合といわれる引力です。
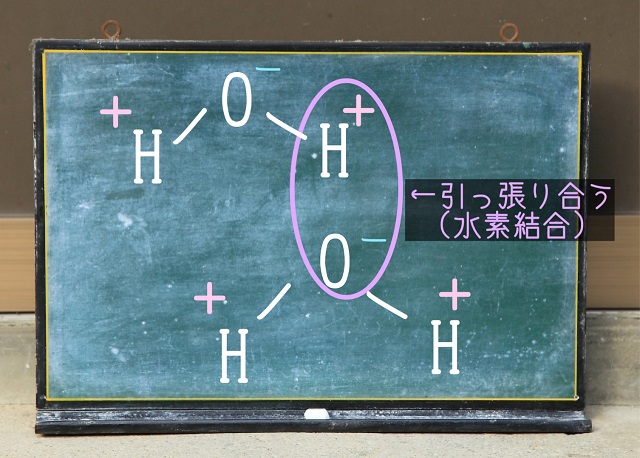
水はOとHの間で水素結合を作りますが、
酸素OがXにもYにもあるわけなので条件を満たしていますよね。
水の水素結合についてはこちらの記事で詳しく解説しています。
⇒分子間力の1つ水素結合の特徴についてわかりやすく解説
それから水素結合により沸点が高くなります。
分子間力が強ければ強いほど、物質の融点や沸点が高くなります。
これは前回の記事で詳しく解説しています。
⇒分子間力の1つ水素結合の特徴についてわかりやすく解説
水の沸点が高いのは水素結合が作られているからです。
水はすごく特殊な物質です。
水は身近に存在しすぎて特殊性を意識しないと思います。
でも、水ほど特殊なものってあまりありません。
水みたいな分子量が小さい物質なのに
沸点が異常に高いのは水素結合のおかげです。
生命が誕生したのは水の水素結合のおかげといっても
間違いではないくらいです。
とにかく水素結合というのは強力な分子間力です。
では水素結合以外にどんな分子間力があるのでしょう?
分子間力の種類|極性引力(静電的相互作用)
次にAとBという分子を考えてきましょう。

AとBという種類が異なる原子が共有結合をしているとしましょう。
共有結合についてはこちらの記事で詳しく解説しています。
⇒化学結合の種類についてわかりやすく解説
そして電気陰性度はA<B(Bの方が大きい)としましょう。
⇒電気陰性度とは?わかりやすく解説
すると、Bの方に電子は引っ張られていきますね。

結果、Aがプラス、Bがマイナスの電荷を帯びるようになりますね。
すると、例えば、上側のB(マイナスの電荷)と下側のA(プラスの電荷)で
引力が働きますね。
ここで働く引力は極性分子間に働く引力なので
極性引力とか静電的相互作用といいます。
極性分子についてはこちらの記事で詳しく解説しています。
⇒極性分子とは?簡単にわかりやすく解説
極性引力(静電的相互作用)は水素結合よりは弱い結合です。
でも、かなり強い力になります。
では分子間力って極性分子はプラスとマイナスに分かれるから
引力が働くのは理解できると思います。
では無極性分子だったらどうでしょう?
たとえば$N_2 $(窒素)とか$O_2 $などの無極性分子だと
分子間力は働かないような気がしませんか?
でも、無極性分子でも分子間力が働きます。
ちなみに無極性分子についてはこちらの記事で詳しく解説しています。
⇒極性分子とは?簡単にわかりやすく解説
以下ご覧ください。
分子間力の種類|無極性分子間
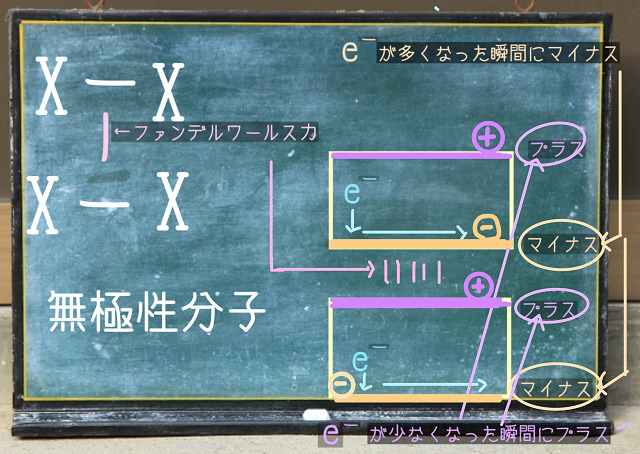
上記図をご覧ください。
X-Xは無極性分子です。
無極性分子では引力が働かないか?というとそんなことはありません。
無極性分子でもファンデルワールス力という引力は働きます。
どうしてでしょう?
大学受験の勉強で無極性分子間の引力については学んでいないと思います。
高校の化学ではファンデルワールス力が働くシステムはスルーしていますからね。
ちょっと難しい話だからです。
でも、私が獣医大学に入学した後の基礎化学の講義で
ファンデルワールス力について学びました。
⇒当ブログ管理人のプロフィール
ここでは大学で学んでファンデルワールス力の基本部分に触れておきましょう。
どんな物質にも電子というマイナスの電荷を持った粒は存在します。
あなたの体にも犬の体にも存在します。
そして電子は常に動き回っています。

上記図の右側をご覧ください。
こんな感じで電子eがグルグル動いています。
で、箱の中に電子が動き回っていると
たとえば、上記図の右側の上側の箱の下側に一瞬ですが電子が集まる瞬間があるでしょう。
逆に下側の箱の上側に一瞬でも電子が集まる瞬間があるでしょう。
すると上側の箱の下側がマイナス、上側は電子が少なくなりプラスになります。
下側の箱は上側がマイナス、下側は電子が少なくなりプラスになります。

するとどうでしょう?
上の箱の下側と下の箱の上側との間に引力が働きますよね。
これがファンデルワールス力といわれている引力です。
瞬間的な電気的な偏りです。
電子がグルグル動き回ることによって瞬間的にプラスやマイナスに分極することがあります。
そのときに働く引力のことをファンデルワールス力といいます。
分子間力の正体はすべて電気的なものです。
電子の移動による電気的な引力です。
分子全体として無極性であっても瞬間瞬間に電子の偏りが見られることがあります。
そのときに引力が働いていることがあります。
そして無力性分子同士で比較したときは分子力が大きい方が引力が強くなります。
たとえば、X-Xの方がY-Yより分子量が大きいなら
働くファンデルワールス力はX-Xの方が大きいです。
どうしてでしょう?
単純に電子の数が多いからです。
グルグル電子がまわって電気的に偏るわけですが
たくさんの電子が動けばその分だけマイナスやプラスの方より強くなりますね。
だから働く引力も強くなります。
分子間に働く引力はすべて分子間力ですが
水素結合>極性引力>ファンデルワールス力
となっています。