この記事では極性と水素結合には
どんな関係があるのか?わかりやすく解説していきたいと思います。
極性と水素結合の関係
水素結合は極性の延長線上にあります。
極性がわからないのに水素結合がわかるわけがありません。
逆に水素結合のことがわからないけど極性についてわかっている人はいるはずです。
「そんなことどうでもいいから、
早く極性と水素結合の関係について教えてくれよ!」
という声が聞こえてきそうなので、では解説していきますね。
では極性から解説しますね。

まず上記図をご覧ください。
1つの箱の中に2個の電子が入っていますよね。
この箱のことを共有電子対といいます。
対(つい)というのは電子が2個、対になってはいっているからです。
詳しい解説はこちらでしています。
⇒化学結合の種類についてわかりやすく解説
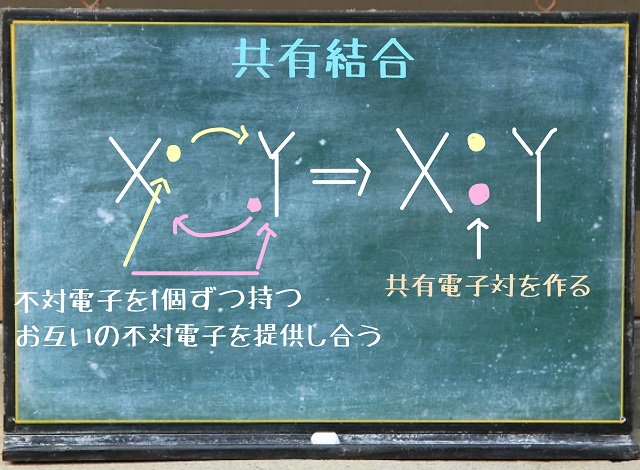
上記図のようなパターンの共有電子対もあります。

それから上記図をご覧ください。
共有電子対が水素Hでなく、
酸素Oの方にちょっと寄っています。
こんな感じで共有電子対がちょっと寄っていることを極性(きょくせい)といいます。
つまり極性とは共有結合している原子間で
共有電子対がどっちかの原子の方に偏っていることをいいます。
もう少し専門的にいうと共有電子対が偏って存在することで電気的な偏りが生じるのですが
そのことを極性といいます。

たとえば$H_2O $全体でみたら電気的にはプラスマイナスゼロです。
でも、中身を見ると酸素(O)の方がちょっとマイナスの電気を帯びます。
共有電子対は電子です。電子はマイナスの電気ですから。
つまり全体で見たら、あるいは外面的にみたらプラスマイナスゼロであっても
中を覗いてみると酸素Oがちょっとだけマイナスの電気を帯びているわけです。
電気陰性度をご存じですか?
⇒電気陰性度とは?わかりやすく解説
電気陰性度とは原子が電子対($e^{ー} $)を引き付ける強さのことです。
で、水素Hというのは他の原子と比べると
電気陰性度が小さいです。
つまり水素Hは電子を引き付ける力が弱いってことです。
だから電気陰性度が小さい水素Hが電気陰性度が大きい窒素Nや酸素Oなどと
結合する場合には共有電子対が水素Hから離れて酸素Oや窒素Nに近寄るわけです。
結果、中身をみると水素は電子が離れるので+になり
酸素Oや窒素Nは電子が近寄るのでマイナス(ー)の電気を帯びるわけです。
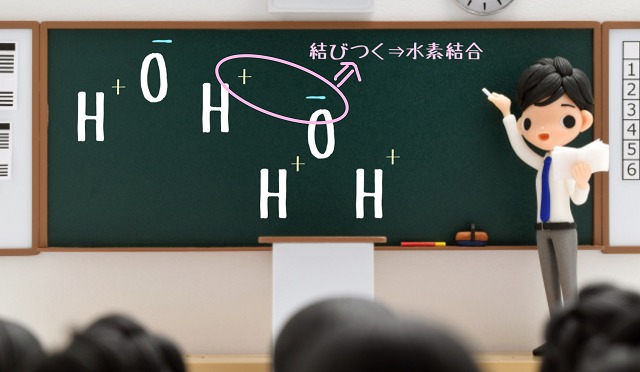
ここまでは極性の解説でした。
$H_2O $だけでみたときに極性によって水素Hがプラスに
酸素Oがマイナスの電気を帯びているところに
さらに$H_2O $がやってきたとしましょう。
それが上記図になります。
このとき$H_2O $のプラスの電気を帯びている水素Hと
別の$H_2O $のマイナスの電気を帯びている酸素Oが電気的に引き合います。
ここは大丈夫ですよね!?
プラスの電気とマイナスの電気は引きあいますよ。
磁石だってプラスとマイナスは引きあいますよね。
そんな感じです。
こんな感じで水素を含む極性を持っている分子(たとえば水)が
水素Hがプラス、もう1つ(たとえば酸素O)がマイナスの電気を帯びていて
その状態で、別の水素を含む極性を持っている分子と
引き合う力のことを水素結合といいます。
だから極性を持っていても
その極性を持っている分子に水素がなければ水素結合はできません。
逆に極性を持っていて、
その分子に水素があるようなら
水素結合ができる可能性があるということです。
ご理解いただけたでしょうか。
以上で解説を終わります。













