前回の記事では構造式の書き方や簡略構造式の書き方について解説しました。
⇒簡略構造式の書き方ルールについてわかりやすく解説
・組成式
・分子式
・示性式
の違いについてわかりやすく解説していきます。
組成式・分子式の違い
まず組成式とか分子式って何なのでしょう?
化合物の元素組成を一番簡単な整数比で表した化学式のこと
です。
整数は-1、-2とか0、1、2のことです。
0.5みたいな小数とか、$\sqrt{3} $みたいな無理数、$\frac{2}{3} $みたいな分数、
3iみたいな虚数は含みません。
整数は-1みたいなマイナスを含むし、0も含むことに注意してください。
次に分子式とは分子を作っている原子の種類であったり数を示したもののことです。
・組成式は比率を表す化学式
・分子式は実際の数を表す化学式
ということです。
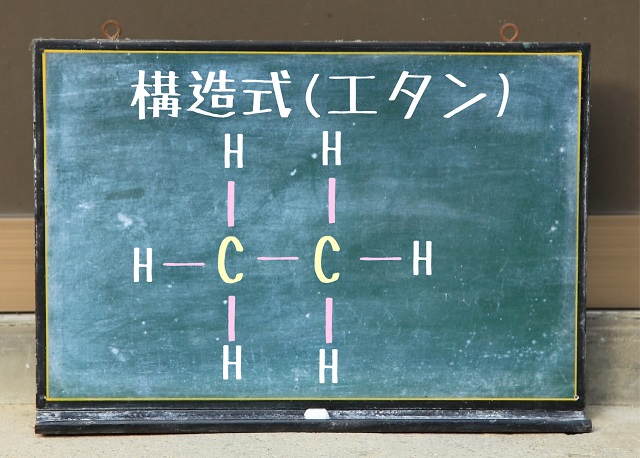
たとえばエタン。
エタンは炭素原子が2つあって水素原子が6つありますよね。
大丈夫ですか?
ということは、エタンは分子式にすると実際の数を表したものなんだから
$C_2H_6 $になりますね。
では組成式はどうなるでしょう?
簡単な整数比で原子数比を表したものです。
炭素と水素の比率って2:6だから簡単にして1:3になりますね。
だからエタンの組成式は$CH_3 $と表すことができます。
・分子式は$C_2H_6 $
・組成式は$CH_3 $
となります。
数の比率を表すのが組成式で分子式は実際の数を表すものという点で両者は違います。
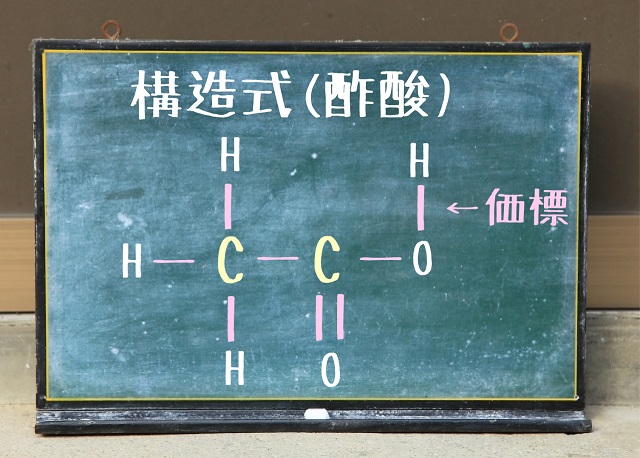
では酢酸はどうなるでしょう?
酢酸は炭素原子が2つあって水素原子が4つあって、酸素原子が2つありますね。
簡単な比率にすると炭素2:水素4:酸素2だから
炭素1:水素2:酸素1になりますね。
だから
・分子式は$C_2H_4O_2 $
・組成式は$CH_2O $
となりますね。
酢酸の場合、組成式は整数比(原子数比)を表現したもので、1:2:1になります。
分子式は実際の数を表現したものだから2:4:2となりますね。
組成式・分子式と示性式の違い
ここまでは組成式と分子式の違いについて説明してきました。
次に組成式・分子式と示性式の違いについて解説していきます。
示性式とは分子式の中の官能基を分けて記したもののことです。
官能基とは性質を特徴づける構造のことです。
なので
その物質の性質を特徴づける構造のこと
(官能基を強調して書いたもの)
です。

たとえば酢酸という化合物はCOOHというのが酢酸の性質を決める構造になります。
COOHはカルボキシ基といわれる官能基です。
なのでカルボキシ基を強調して示性式を表現します。
なので酢酸を示性式で表すと$CH_3COOH $となります。
「カルボキシ基を持ってますよ」ということをアピールした書き方のことを示性式といいます。
その化合物の性質を決める構造を強調して表現したものが示性式です。
酢酸で組成式、示性式、分子式を表すと
・分子式は$C_2H_4O_2 $
・組成式は$CH_2O $
・示性式は$CH_3COOH $
となりますね。
組成式、分子式、示性式の違いまとめ
・組成式は比率を表す化学式
・分子式は実際の数を表す化学式
・示性式はその化合物の性質を決める構造(官能基のこと)を強調して表現したもの
です。
以上で解説を終わります。