化学反応が起こる仕組みってどんなものがあるでしょう?
いろいろありますが、
・弱酸遊離反応
・熱分解反応
・酸化還元反応
などがあります。
上記3つの化学反応はすべて気体が生じる反応です。
今回の記事では弱酸遊離反応とは何か?
わかりやすく解説していきます。
弱酸遊離反応とは?

弱酸遊離反応は化学の参考書を見たら
たいてい掲載されていると思います。
弱い酸の塩+より強い酸⇒より強い酸の塩+弱い酸
という反応のことです。
これが弱酸遊離反応のパターンですが、これがきちんとわかっている人はすごく少ないです。
ということで、しっかりこの弱酸遊離反応の反応パターンを頭に入れていきましょう。
ところで弱い酸の塩+より強い酸⇒より強い酸の塩+弱い酸と書きましたが、
いったい何を言っているのでしょう?
より強い酸⇒より強い酸の塩
のところです。
これは強い酸の方が塩になりやすいことを意味しています。
ちなみに「酸って何?」って方はこちらをご覧ください。
⇒酸とは何?わかりやすく解説
左の式で弱い酸が塩になっているときにより強い酸が入ってくると
強い酸の$H^{+} $が弱い酸に渡されて、弱い酸の陽イオンが強い酸に渡されます。
結果、右の式に移り、強い酸の塩ができるという話です。
ではそもそも『塩(エン)』って何なのでしょう?
塩は『しお』じゃなく、『エン』と読みます。
弱酸遊離反応の前提知識:塩って何?
たとえば、$H_2SO_4 $(硫酸)で考えていきます。
$H_2SO_4 $(硫酸)は$H^{+} $(水素イオン)が2つあります。
塩というのは$H^{+} $(水素イオン)の代わりに別な陽イオンがついたものと考えておけばOKです。
たとえば、$H_2SO_4 $⇒$Na_2SO_4 $
と水素イオンの代わりに$Na^{+} $(ナトリウムイオン)がついているケース。
こういうのが塩という構造なのです。
こんな感じで塩というのは$H^{+} $(水素イオン)の代わりに別な陽イオンがついたものを指します。
今、$H_2SO_4 $⇒$Na_2SO_4 $
$H^{+} $(水素イオン)2つが$Na^{+} $(ナトリウムイオン)2つに代わりました。
こういうのが塩です。
$H_2SO_4 $(硫酸)には$H^{+} $が2つあります。
ということは2つの$H^{+} $のうち、
1つだけ別の陽イオンに置き換わるということもあり得ますね。
たとえば、NaH$SO_4 $
といった感じです。
この全部入れ替わった$Na_2 $$SO_4 $、みたいなタイプを『正塩(せいえん)』、
一部だけ入れ替わったもの($H^{+} $が一部残っているもの)、NaH$SO_4 $みたいなタイプを酸性塩(さんせいえん)といいます。
全部かわった、一部かわったで分けているんですね。
塩基も同様です。
$Ca(OH)_2 $(水酸化カルシウム)という塩基があります。
ちなみに「塩基って何?」って方はこちらをご覧ください。
⇒アルカリと塩基の違いをわかりやすく解説
塩基に関しては塩という場合、
$OH^{ー} $(水酸化物イオン)が別な陰イオンに置き換わったものと考えたらOKです。
たとえば、
$Ca(OH)_2 $⇒$CaCl_2 $と$OH^{ー} $が$Cl^{ー} $に置き換わったとしましょう。
これで塩です。
$OH^{ー} $が2個あるということは1つだけ別な陰イオンに代わって
$CaCl(OH) $と$と1個はそのまま$OH^{ー} $の形で残るってこともあるでしょう。
で、全部$OH^{ー} $が2つとも別な陰イオンに置き換わっている塩(例:$CaCl_2 $)を正塩といいます。
一部$OH^{ー} $が置き換わった塩(例:$CaCl(OH) $)を塩基性塩といいます。
ということで塩って何か?といわれたら
以上のように理解しておかえばOKです。
酸の水素の代わりに別な陽イオンがついたもの、
あるいは塩基の$OH^{ー} $のかわりに別な陰イオンがついたものと考えて問題ありません。
だから、たとえば、$Na_2SO_4 $という化学式を見て
「これはいったい何の塩なんだろう?」と疑問に感じたら
$Na^{+} $という陽イオンを$H^{+} $に置き換えてみたら元の酸が見えます。
ここでは$H_2SO_4 $だとわかります。
あるいは$CaCl_2 $(塩化カルシウム)ってどういう塩なのかな?
となったら$Cl^{ー} $を$OH^{ー} $に置き換えて考えたみたらよいです。
すると$Ca(OH)_2 $(水酸化カルシウム)という塩基が見えてきますね。
以上を前提にして弱酸遊離反応について再度考えていきましょう。
弱酸遊離反応
弱い酸の塩+より強い酸⇒より強い酸の塩+弱い酸
という反応のことでしたね。
弱い酸が塩になっているところにより強い酸が入ってくると
より強い酸が塩になって、弱い酸は塩の形から元の酸の形に戻るというのが
弱酸遊離反応の考え方です。
たとえば、『酸の強さ』というの所持金の多さだと考えてみましょう。
『塩になる』というのを投資家になると考えてみましょう。
所持金が多い人ほど投資家として成功しやすいでしょう。
所持金がほとんどなかったら株式だって1つも買えません。
ビットコインだって買えないでしょう。
またお金をいっぱい持っている方が焦りもないから
リターンが少ないけど、暴落しないところに投資するから失敗しにくいです。
でも、所持金が少ないけど、なんとかしてお金を増やしたい人ほど
ハイリスクハイリターンの投資をしてしまって失敗します。
所持金が多い人の方が投資家として成功して
所持金の少ない人は投資家として失敗して、投資の世界から撤退してしまいます。
たとえば弱い酸の塩ってことは所持金の少ない人が投資家になっている状態です。
そこにより所持金の多い投資家が入ってきました。
その人が投資家として成功して所持金の少ない投資家は失敗してしまい
投資業界から去っていくでしょう。
こんな感じで投資家入れ替え戦とみれば
弱酸遊離反応が理解しやすくなりますね。
どんな酸の塩なのか、より強い酸になっているかな?
ということがわかれば反応する、反応しないというジャッジができるわけですね。
では、具体的に化学反応式を使って弱酸遊離反応が適応できるかどうか?
考えていきましょう。
弱酸遊離反応の具体例
例として
$CaCO_3 $+$2HCl $⇒$CaCl_2 $+$H_2O $+$CO_2 $
があります。
$CaCO_3 $(炭酸カルシウム)って炭酸のカルシウム塩ですよね。
炭酸って$H_2CO_3 $という化学式で書くことができますね。
この$H^{+} $(水素イオン)2つがカルシウムイオンという2価の陽イオンに置き換わった形をしているので
$CaCO_3 $(炭酸カルシウム)というのは炭酸のカルシウム塩といえます。
炭酸というのは弱酸の塩で、塩酸$HCl $は強い酸です。
すると反応後は$CaCl_2 $(塩化カルシウム)になっています。
$CaCl_2 $はカルシウムイオンを$H^{+} $(水素イオン)に戻すと$HCl $ですよね。
つまり、$CaCl_2 $は$HCl $(塩酸)という強い酸の塩になっているわけですね。
そして$H_2O $+$CO_2 $ですが、これは炭酸ガスですよね。
弱い酸が遊離しているわけです。
どうして$H_2O $+$CO_2 $を$H_2CO_3 $と書かないのか知ってますか?
疑問に感じる方がいます。
$H_2CO_3 $というのは、水に少ししか溶けません。
ほとんどは$CO_2 $という気体になって外に出ていきます。
なので、$H_2CO_3 $が最初できますが、ほとんどは$H_2O $と$CO_2 $に分かれて
外に気体として出ていく形になるので、$H_2O $+$CO_2 $と記載します。
反応式というのは割合が大きいほうを書くのが大原則なので
$H_2O $+$CO_2 $となります。
これが弱酸遊離反応の典型例です。
ちなみに$CaCO_3 $だったら$HCl $と反応しますね。
でも、これが$CaSO_4 $(硫酸カルシウム)だったらどうなるでしょう?
硫酸カルシウムは硫酸の塩ですね。硫酸は強酸ですね。
強酸の塩の場合だと反応しません。
$CaCO_3 $という弱酸だから反応するのであって$CaSO_4 $だったら反応は起きません。
こういうところが重要です。
なぜレントゲンの造影剤は硫酸バリウムを使うの?

私は獣医師として日々、ペットの診療をしています。
たまに造影検査として犬や猫に$BaSO_4 $(硫酸バリウム)を飲ませてレントゲン写真を撮影することがあります。
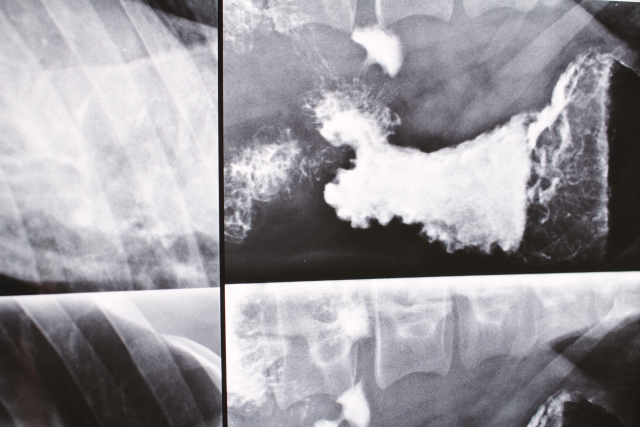
でも、$BaCO_3 $(炭酸バリウム)を犬や猫に飲ませません。
$BaCO_3 $も$BaSO_4 $もどちらもレントゲンの造影剤として使える性質を持っています。
でも、実際の医療現場で使うのは$BaSO_4 $だけです。
$BaCO_3 $はレントゲンの造影剤としては使えません。
どうしてでしょう?
同じような反応をするのに。
胃の中は塩酸で酸性になっています。
$BaCO_3 $(炭酸バリウム)って胃の中で溶けてしまうのです。
$BaCO_3 $は弱酸の塩だからです。
なので、強酸の塩である$BaSO_4 $(硫酸バリウム)をレントゲンの造影剤として利用するのです。
こんなことも弱酸遊離反応ことがわかっていたら、
すぐに頭に入ってくることでしょう。
こんな感じで仕組みを理解することが重要で反応式を
理解抜きで暗記してはいけません。
私も獣医大学受験のときに必死で理解しました。
この記事を読んでいるあなたも、弱酸遊離反応を理解して
大学受験を突破してくださいね。
応援しています!