結晶ってどんなイメージがありますか?
きれいな結晶が多いですよね。
渋沢鉱山
黄鉄鉱にまたウニを映してみました。
この結晶の断面は、採取した中でも一番綺麗。鏡の様です。 pic.twitter.com/TDKc5OaVbR— 水晶沢 (@kousheki1) May 21, 2022
ですが、あなたがこの記事を見ているスマホ、ipad、パソコンの画面、
あなたが座っているイスなど、化学では固体をみんな結晶といいます。
なので、きれいであろうが汚かろうがみんな結晶です。
くどいようですが、この記事は化学にフォーカスしているので
結晶=固体のことです。
高校化学では基本的に計算で出てくる固体はすべて結晶!
だけど、粒子が不規則に集合したアモルファス(非晶質)と呼ばれるものもある♪— 化学時々つまらないbot (@s2NiQVIzwwk8qin) April 22, 2022
今回の記事は化学結合の知識が前提になります。
もしここから解説する内容が理解できない場合には
こちらの記事を読んでから戻ってきてくださいね。
⇒化学結合の種類についてわかりやすく解説
化学でよく出る結晶の種類:共有結合結晶
共有結合で出来上がった結晶を共有結合結晶といいます。
⇒化学結合の種類についてわかりやすく解説
たとえば炭素の仲間であるダイヤモンドやケイ素、あるいは二酸化ケイ素、炭化ケイ素があります。
化学結合はみんな強い結合をしていますが
その中でも共有結合はとっても強いです。
だからとにかく硬いという特徴があります。
また、結合力が強いということは切るためにいっぱいエネルギーが必要です。
つまり融点が非常に高いという特徴が共有結合結晶にはあります。
ダイヤモンドを想像すれば理解しやすいですよね。
化学でよく出る結晶の種類:イオン結晶
金属と非金属でイオン結合ができるんでしたね。
⇒化学結合の種類についてわかりやすく解説
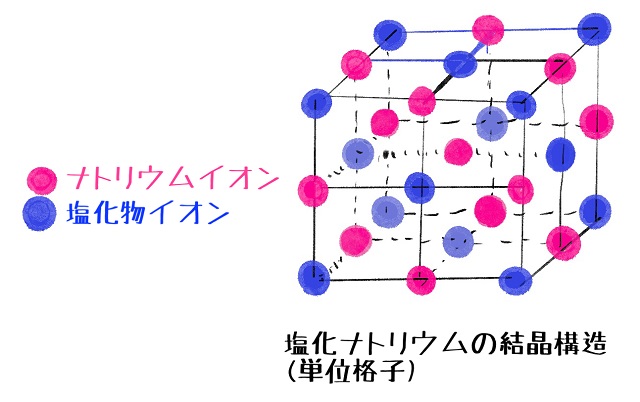
イオン結合でできた塊をイオン結晶といいます。
たとえば食塩の結晶はイオン結晶です。
⇒塩化ナトリウムの結晶格子と密度の求め方についてわかりやすく解説
ところでイオン結晶という塊の状態では『絶縁体』です。
絶縁体=電気を通さないということですね。
電気をまったく通さない物質のことを絶縁体といいます。
そしてイオン結晶は溶解あるいは融解して溶かすと導体(電気を通す)になります。
溶解は水を加えて溶かすことです。
たとえば食塩に水を加えて溶かしたら溶解といいます。
融解は水は加えずに熱を加えてダイレクトに溶かすことです。
大丈夫ですか?
イオン結晶はもともとイオンです。
イオンというのはプラスとかマイナスとか電気を持っていますから
電気を通す素質は持っています。
自由に動ければ当然電気を通します。
でも、結晶ではプラスのイオンとマイナスのイオンが互い違いになって
きっちりとくっついていて動けません。
だからイオン結晶では電気を通しません。
でも、溶かすことによって自由に動くことができれば
もともと電気を持っているから導体になります。
たとえば食塩の塊は電気を通しませんが
食塩水あるいは800℃くらいに熱を加えて溶かした食塩は電気を通します。
⇒塩化ナトリウムの結晶格子と密度の求め方についてわかりやすく解説
化学でよく出る結晶の種類:金属結晶
たとえば鉄の塊は金属結晶です。
金属結晶はどうやってできているのでしょう?
もちろん金属結合でできあがっています。
A.塩化マグネシウム
二酸化ケイ素→共有結合
鉄→金属結晶
ナフタレン→共有結合、ファンデルワールス力
が含まれる。— ひでと⌬Quimica化学講師 (@akane_chemistry) May 18, 2022
金属は電子を出したがるので
金属同士の結合である金属結合がお互いに電子を出したがるわけですね。
結果、自由電子が存在するのが金属結合の特徴でした。
⇒化学結合の種類についてわかりやすく解説
そんなこともあって電気や熱を通しやすいですし、
展性や延性があるわけです。
つまり変形しやすいってことです。
この辺はとにかくこちらの記事でくどいくらいに説明していますので
興味のある方はご覧ください。
⇒化学結合の種類についてわかりやすく解説
化学でよく出る結晶の種類:分子結晶
前回解説した化学結合を思い出してくださいね。
原則は3つと特殊な配位結合が1つありましたね。
ところが結晶は原則として4つあります。
4つ目の結晶は分子結晶です。
分子結晶は分子間力で出来上がっています。
⇒化学結合の種類についてわかりやすく解説
ドライアイスを知っていますか?
ケーキ屋さんに行くともらえるやつです。
ドライアイス初体験💝✨
#アメショー #アメショ pic.twitter.com/uASllb7He1— サン・サン️️️️️️️☀️|オンライン診療代理店 (@sunsun_) May 22, 2022
ドライアイスは二酸化炭素です。
二酸化炭素は昇華します。
固体から液体に直接変わるやつです。
詳しくはこちらで解説しています。
⇒二酸化炭素の状態図の特徴をわかりやすく解説
ドライアイスの塊を考えましょう。
以下のように二酸化炭素分子があるとしましょう。
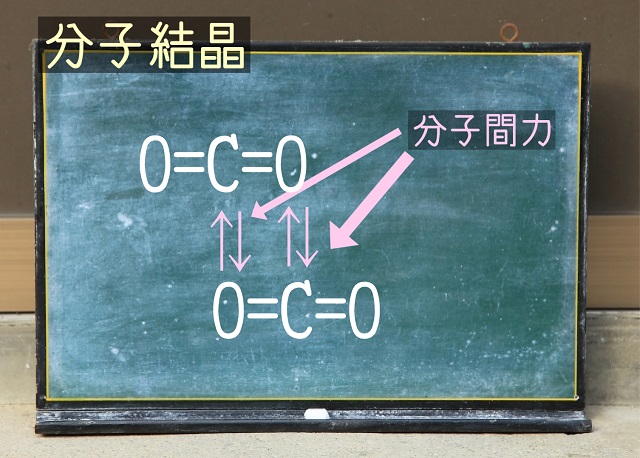
上記結合は金属と非金属ですから共有結合です。
⇒化学結合の種類についてわかりやすく解説
さっき言いましたが共有結合はすごく強い結合です。
ですが、ドライアイスの塊というのは上記画像のピンクの矢印で引いた結合でできています。
この矢印は分子間力(ファンデルワールス力)です。
⇒分子間力とは?わかりやすく解説
⇒分子間力の種類
ドライアイスをもし壊すとしましょう。
そのために強い共有結合(O=C=Oの=部分)を切る必要はありませんね。
ドライアイスを壊すために弱い分子間力を切ればよいです。
なので、壊すという事を考えると結晶がどういう力でできているか
想像しやすくなるでしょう。
結合の強さは共有結合の方が分子間力よりも圧倒的に強いですからね。
つまり分子は共有結合でできているけど
結晶は分子間力でできているということです。
二段構えなのでちょっとややこしい話でしたね。
分子結晶というのは共有結合といっても
共有月号結晶は記事冒頭でご紹介した
ダイヤモンドやケイ素、あるいは二酸化ケイ素、炭化ケイ素しかありません。
あとはみんな分子結晶です。
分子結晶は分子間力なので結合が弱いためすぐに切れます。
なので、共有結合結晶と性質は正反対です。
つまり分子結晶の特徴は柔らかいです。
共有結合結晶のダイヤモンドと分子結晶のドライアイスを比べたら理解しやすいでしょう。
ドライアイスを投げたらすぐに壊れますよね。
また、分子結晶はすぐに切れるので少ないエネルギーで溶けたり昇華します。
なので融点が低いという特徴があります。
以上で解説を終わります。