以前の記事で有機化合物の表示法の中でも組成式、分子式、示性式を
特に詳しく説明しました。
⇒組成式・分子式・示性式の違いについてわかりやすく解説
今回の記事では前回の復習をからめながら
構造式と示性式の違いについてわかりやすく解説していきます。
構造物と示性式の違いを理解するための前提知識
現在は機械が発達しているので
有機化合物を機械の中に入れると分子量がわかったり
炭素と水素が何対何でくっついているかわかったり
その有機化合物にどんな官能基がくっついているかわかるようになりました。
たとえば、質量分析計(MS)を使えば有機化合物の分子量がわかります。
低分子化合物の分子量って計算とかMS測定すれば簡単に求まるんだけど、高分子はそう簡単にいかないのよね。一番ポピュラーな方法でGPCがあるけど、そのデータを解析する検量線が調べたい化合物の検量線じゃないと結局相対的な分子量しか求められないから大変だよね。それでMALS使って絶対分子量を求め
— あらごん (@aragon1811) September 10, 2019
また、IR測定をすれば官能基の特徴的な赤外吸収がわかるため、
どんな官能基かを判断することができます。
赤外線IRのエネルギーEでは、結合(H-O-HのH-O)を伸縮させたり(バネのようにHとOが近づいたり離れたりする)、結合角(H-O-Hの∠HOH)を変化させたり(H同士がOを中心として近づいたり離れたりする)でき、また結合によりそのEが異なることから、科学者は分子の官能基(構造)を決定するのにIRを利用します😆 https://t.co/FlCVSIA8Sq
— SHIO@化学屋さん🧪 (@drLogouT) December 7, 2021
NMR測定をすればどんなC-H結合があるか判断することもできます。
助手になった年に科研費の萌芽的研究で数十万円取れて,NMR測定用の高い溶媒を購入して測定した結果が一連の論文のスタートになりました。研究のスタートの呼び水も枯れてしまっているような今の大学の状況はまさに飢饉です。 https://t.co/6JAYIN01yX
— こなみひでお (@konamih) October 9, 2020
こんな感じで有機化合物の構造を壊さないで炭素や水素がいくつあるかなど
わかるようになっています。
ただ、昔は有機化合物を測定する機会がありませんでした。
じゃ、どうやって測定したか?
燃焼させることで測定していました。
C(炭素)は二酸化炭素($CO_2 $)にしてHは水($H_2O $)にして
それから$CO_2 $や$H_2O $のグラム数を測定して
それから$CO_2 $に含まれているCのグラム数を測定して
$H_2O $の中に含まれているHのグラム数を測定して
結果、CとHが何対何でくっついているのか?調べていました。
昔の人は一生懸命頑張って調べてていました。
そうやって、たとえばC:H=1:3
だと測定していたんですね。
C:H=1:3だとわかったら$CH_3 $だということですね。
こんな感じで1対3でくっついているという比(組成)がわかり、
$CH_3 $と表示することを組成式といいます。
組成式はこんな実験室で必死で努力して出したものなので実験式ということもあります。
$CH_3 $・・・組成式、実験式
ただ、組成式(実験式)では炭素と水素があくまで1対3でくっついていることだけがわかっただけです。
どういうことかというと、たとえばCが1でHが3なのか、Cが2でHが6なのか、Cが3でHが9なのか
Cが4でHが12なのかわからないってことです。
そのため、さらに分子量を調べて実際のCとHがCが2でHが6なのか、
Cが3でHが9なのか計算して求めていました。
超めんどくさいですね。
私はめんどくさがりで、ギターが好きなのですが、
チューニングが面倒くさいから何度も何度も挫折した経験があるくらいです。
「緑の風のアニー」を演るには12弦ギターが最適なんだが、チューニングが面倒くさい。
ジョンデンバーはライブで観客を笑わせながら、チューニングをこなしてしまうのだからすごい。
やはりプロ中のプロは、たいしたものだと今さらながら思う。
「太陽を背にうけて」「わが友カリプソ号」も12弦だ。 pic.twitter.com/b9PIlODhm0— コルベット (@OMKfGbfaSE4ikUy) March 29, 2021
ギターのチューニングより分子量を調べる方がもっと面倒です。
昔の人はよく頑張りましたね。
話を元に戻して、
分子量を計算した結果、$C_2H_6 $だったとしましょう。
分子量から求めたことから$C_2H_6 $を分子式といいます。
・$CH_3 $・・・組成式、実験式
・$C_2H_6 $・・・分子式
ということです。
構造式と示性式の違い
この分子式を見たら
どんな感じで炭素が結合しているのか知りたいと思うのが化学者でしょう。
炭素は手が4本です。水素は手が1本。
⇒炭素原子の結合の手についてわかりやすく解説
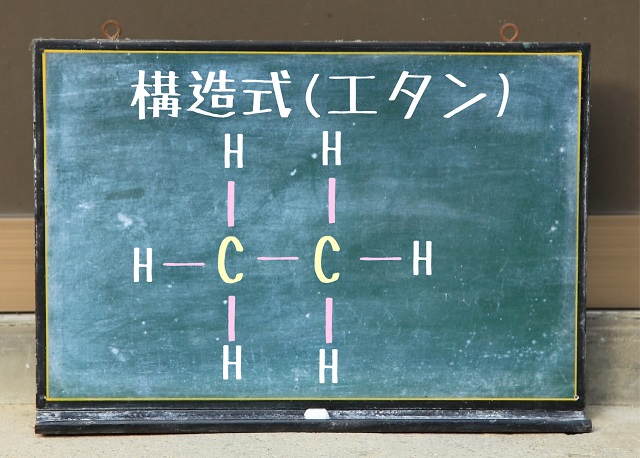
炭素の手4本と水素の手1本を結合させようということで
炭素と水素を結合させていくと上記画像のようになります。
こんな感じですべての非金属同士の結合は以前解説しました共有結合ですね。
⇒化学結合の種類についてわかりやすく解説

すべての共有結合の手を伸ばした状態で書いたものを構造式といいます。
なので上記画像は構造式です。
・$CH_3 $・・・組成式、実験式
・$C_2H_6 $・・・分子式
・結合の手を伸ばした状態で書いたもの・・・構造式
構造式は構造式で結合している様子がよくわかるのでいい感じではないでしょうか。
でも化学の授業を受ける上で書くのが面倒くさくないですか?
また、教科書に書いてある有機化合物の構造式を全部
ノートに書き写そうとしたら、大変なことになりますよね。
構造式書くのマジでストレス溜まる面倒くさい
— 乙軽 (@soarcx) February 5, 2022
もうちょっと省略して書いた方が楽ですし、
別に構造式まで書かなくても、どんな有機化合物か理解することはできます。

そこで水素の手を省略して書こうとしました。
上記画像のような式が略式構造式とか簡略構造式といいます。
⇒簡略構造式の書き方ルールについてわかりやすく解説
でも略式構造式さえ書くのが面倒くさいという方もいるでしょう。
そこで二重結合と三重結合以外の結合の手を全部省略したものが示性式といいます。
たとえばエタンの示性式は$CH_3CH_3 $です。
示性式(しせいしき)の特徴は官能基はわかるように書くのが特徴です。
性質を示すと書いて示性式です。
官能基はその有機化合物の性質を決定するわけですからね。
ただ、炭素と炭素の二重結合や炭素と炭素の三重結合は省略せずに書きます。
ということで全部省略せずに結合の手を伸ばした状態で書いたものが構造式で
構造式で示された二重結合と三重結合は省略せず、
他は省略しながら官能基はわかるように書いたものが示性式です。
・$CH_3 $・・・組成式、実験式
・$C_2H_6 $・・・分子式
・結合の手を伸ばした状態で書いたもの・・・構造式
・構造式から水素の手を省略して書いたもの・・・略式構造式
・構造式から官能基が分かる形で二重結合と三重結合以外の結合の手を全部省略したものが示性式
です。
だから本当は構造式を書けといわれたら
すべての結合の手を伸ばして書かないといけません。
たとえば構造式だったら『OH』と書いたら×です。
これは示性式の書き方です。
構造式なら『OH』と省略せずに『O-H』と
OとHの間の結合の手も省略せずに書かないといけません。
以上で解説を終わります。