前回の記事では反応速度を理解する大前提となる
活性化エネルギーや活性化状態とはどういうことなのか解説しました。
⇒活性化状態(活性化エネルギー)とは?わかりやすく解説
化学反応速度を支配する要因にはどんなものがあるでしょう?
・温度
・濃度
・触媒
があります。
温度、濃度、触媒の3つによって反応速度は変化します。
今回の記事では反応速度と温度・濃度・触媒の関係についてわかりやすく解説していきます。
反応速度と濃度の関係
まず濃度が変わるとなぜ反応速度は変化するのでしょう?
反応物の濃度が大きいと、
反応物同士がぶつかりやすくなるわけです。
そもそも反応物同士が衝突しないと反応しません。
反応物同士が同じ空間にあるだけでは反応しません。
分子同士がぶつかって化学反応が起こります。
だから衝突しやすい状況を作れば反応しやすいということです。
衝突しやすいということは数が多いということです。
数が多いということは濃度が高いということ。
反応物の濃度が大きくなると(高くなると)
衝突頻度が増すので反応速度が大きくなるといえます。
反応速度と温度の関係
温度が高いと反応速度が大きくなります。
どうして温度が高いと反応速度は大きくなるのでしょう?
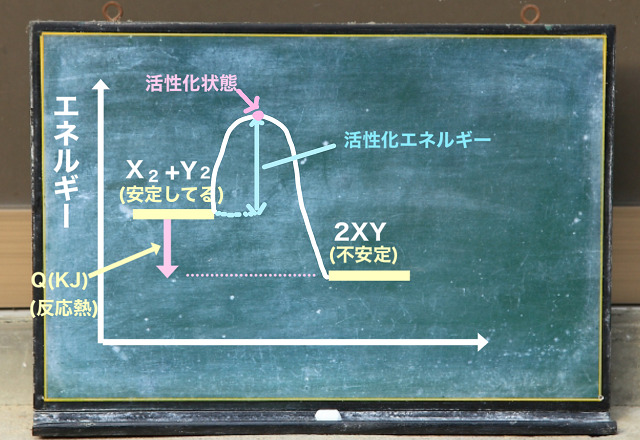
上記図は前回解説した活性化状態や活性化エネルギーを説明したものです。
⇒活性化状態(活性化エネルギー)とは?わかりやすく解説
XやYといった分子がぶつかっても活性化エネルギーより
小さいエネルギーしか獲得できなかったらもとに戻されてしまうからです。
前回解説した
$X_2 $+$Y_2 $⇒$2XY $+$Q KJ $($Q>0 $)
という反応なら$2XY $にならずに、$X_2 $+$Y_2 $のままということです。
活性化エネルギー以上のエネルギーを獲得できないと
活性化状態が頂点の山を越えられません。
温度が高くなると大きなエネルギーでぶつかれるのです。
温度が高くなると大きなエネルギーを持った分子が増えてくるから
ぶつかったときに活性化エネルギー以上のエネルギーになることが確率として高まるということです。
温度が高いと反応物の運動エネルギーが大きくなり
活性化エネルギー以上のエネルギーを持った分子の数が増える、
だから反応速度が大きくなるわけです。
「ちょっとよくわからない・・・」という方、
温度はエネルギーということをこちらの記事で説明しているのでご覧ください。
⇒発熱反応で温度が上昇する理由とは?
反応速度と触媒の関係
触媒を加えると反応速度は大きくなります。

触媒というのは前回解説した活性化エネルギーの山を低くする働きを持った物質です。
より低い活性化エネルギーの経路で反応が進行する事が可能です。

例えるなら山の間にトンネルを掘ったような感じです。
トンネルを掘った方が大きな山を登って乗り越えるより
山の向こうに到着する時間は短くなりますよね。
そんな感じです。
活性化エネルギーがより低い経路で反応が進行する事が可能になるので
反応は起こりやすいということです。
触媒がないときよりも触媒があるときの方が活性化エネルギーが低くなるから
反応が早く進行することができるようになります。
反応速度と温度・濃度・触媒の関係まとめ
以上、温度、濃度、触媒と反応速度の関係を理解しておきましょう。
衝突頻度が増すというのが濃度です。
温度の関係は活性化エネルギー以上のエネルギーをもつ分子の数が増える、
ぶつかった時に大きなエネルギーを獲得できるから反応速度が大きくなるわけです。
触媒は活性化エネルギーがより低い経路で反応の進行が可能になるから
反応速度が速くなるということです。
以上で解説を終わります。















