・電解質とは?
・非電解質とは?
・電解質と非電解質の見分け方
・覚えるべき電解質と非電解質
について解説します。
Contents
電解質・非電解質とは?
まずビーカーの中に水を用意します。

ビーカーの中に用意した水、
これを溶媒(ようばい)といいます。
次に水の入ったビーカーの中に
食塩を溶かしましょう。
この塩が溶質(ようしつ)になります。
こんな感じで溶媒を用意して溶質を溶かして
溶かし終わると溶液(ようえき)になります。
ところでイオンに分かれることを電離するといいます。
この溶質の中には
『水に溶かして』陽イオンと陰イオンに分かれるもの(電離することができるもの)を電解質といいます。
つまり溶質の中に電解質があるってことです。
別の言い方をすると
水に溶かすとその水溶液に電流が流れるようになる物質
(電気を通すようになる物質)を電解質といいます。
・水に溶かす前は電気を通さない
・水に溶かすと電気を通すようになる
物質のことです。
たとえば$NaCl $(塩)という固体は電気を通しません。
でも水に溶かして食塩水になると電気を通すようになります。
こういう物質($NaCl $)を電解質といいます。
どうして$NaCl $を水に溶かすと電気を通すようになるのでしょう?
$NaCl $を水に溶かすと$Na^{+} $と$Cl^{ー} $に電離します。
蒸留水というのは電気をほとんど導きません。
でも $NaCl $を水に溶かすと$Na^{+} $ と$Cl^{ー} $に電離し
イオンが出てくるので電気を導くようになるのです。

水の中に電解質の1つである$NaCl $を溶かしてみたとしましょう。
$NaCl $は以前解説しましたがイオン結晶の状態です。

すると$Na^{+} $の周りにはいっぱい$Cl^{ー} $がありますから
上記画像のようにいっぱいつながっていられるわけですね。
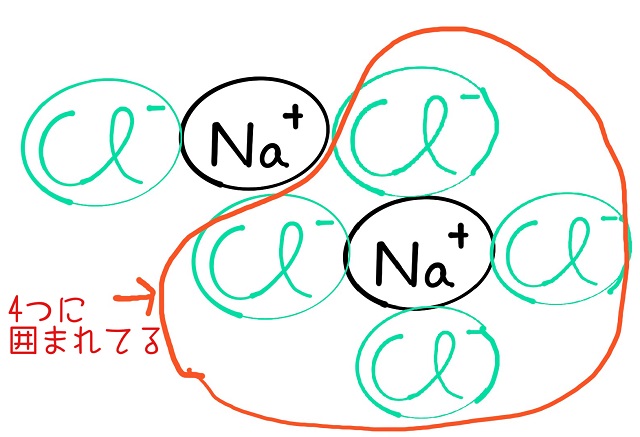
$Na^{+} $の周りは$Cl^{ー} $4つによって
囲まれていますね。
するとあっちこっちとつながっていられるわけですね。
だから言い方を変えると手が4本あるような状態になっています。
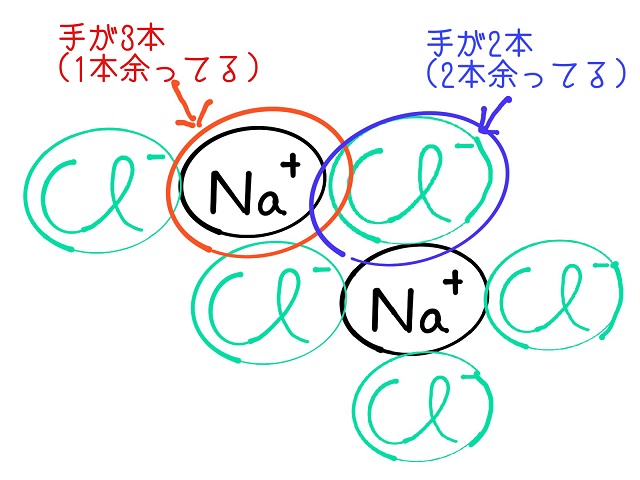
ところが塩の結晶の表面部分の$Na^{+} $というのは
上記画像だと手が3本つながっていますが、
1本余っていますよね。
$Cl^{ー} $も同様です。
本当は$Cl^{ー} $も$Na^{+} $4つに取り囲まれているのですが
2つしか手がついてないところがあります。
言い換えると手が余っているような状態なので
他とくっつきやすいです。
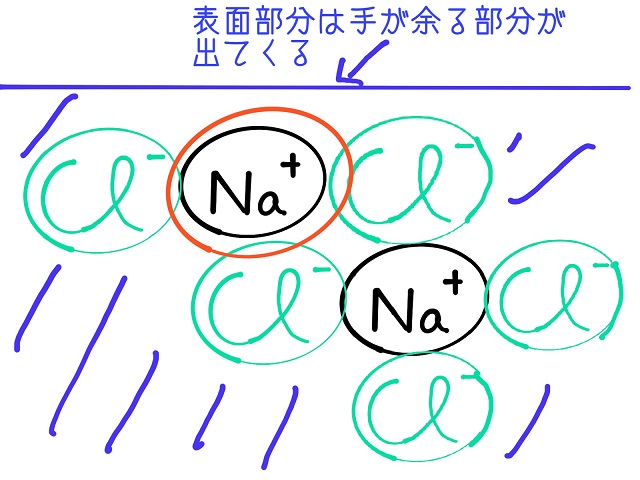
上記画像のように表面部分というのは
手が余る部分が出てくるため結合力が余っていて
反応しやすくなっているのです。
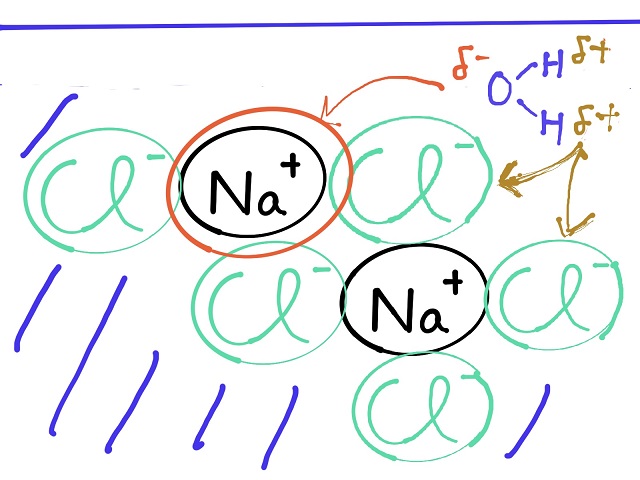
そして水に溶けているわけです。
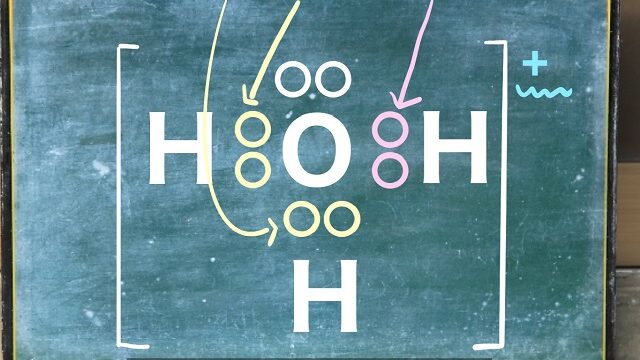
水は上記画像のようにマイナスとプラスに分極しています。
これと表面の手の余っている$Cl^{ー} $と$Na^{+} $がいるわけです。
そこでプラスとマイナスに分極している水が
手が余っている$Cl^{ー} $や$Na^{+} $に寄っていきます。
こんな感じで少しずつ角や表面のところにある$Cl^{ー} $や$Na^{+} $を
取り囲んで行って、最後は引き離していきます。
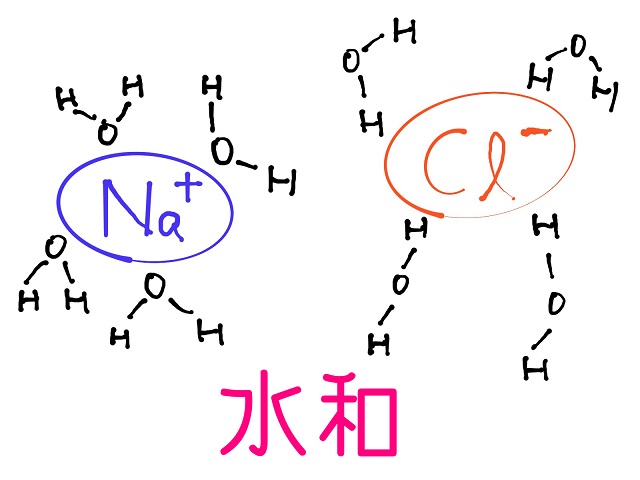
そうすると$Cl^{ー} $の周りにプラスのHの部分が
寄って行った形で水が、
$Na^{+} $の周りにマイナスのOが寄って行った形で水が
取り囲まれていきます。
こういう形を水和したといいます。
溶媒が水でなければ溶媒和といい
特に水の場合は水和といいます。
普段の生活とか電気の話で説明すると
電解質を蒸留水に溶かしてあげると蒸留水が電気を通すようになるということです。
話を元に戻しますね。
水に溶かしてもイオンに分かれないものもあります。
こういうのを非電解質といいます。
たとえば砂糖(ショ糖とも)は水に溶かしてもイオンに分かれません。
だから水に砂糖を溶かしたあと、電気を流しても
電気は流れません。
なのでショ糖(砂糖)は非電解質になります。
電解質と非電解質の見分け方について
ここまで電解質と非電解質とは何か?
解説してきました。
では試験本番で電解質と非電解質を
どうやって見分けたらよいのでしょう?
電解質は先ほど解説したように
水に溶けると陽イオンと陰イオンに分かれます。
だから「この物質を水に溶かしたら陽イオンと陰イオンに分かれるかな?」
っていう見方をすることが大事です。
先ほども解説した$NaCl $は電解質の1つですが、
水に溶かすと$Cl^{ー} $と$Na^{+} $に電離しますね。
こういうことが感覚的にわかる、あるいは暗記することが
電解質か非電解質か見分けるのに重要です。
大学受験の化学ということなら
あとでお伝えしますが、試験に出題されそうなものって決まってます。
実際は無数にあるかもしれませんが
受験ということなら有限であり暗記可能です。
なのでそこまで心配しないでください。
あとそれから水に溶かして酸性やアルカリ性を示す
ものも電解質です。
これは以前解説しましたが
酸性になるものは$H^{+} $(水素イオン)が発生しますし
アルカリ性を示すものは$OH^{ー} $(水酸化物イオン)が発生しますね。
だからpHを計算できるわけですよ。
pHを計算するためには【$H^{+} $】(水素イオン濃度)か
【$OH^{ー} $】(水酸化物イオン濃度)のどちらかが必要でしたね。
よくわからない方はこちらをご覧ください。
だから水に溶かして酸性やアルカリ性を示す物質は電解質といえます。
たとえば塩化水素HClは水に溶かすと塩酸になりますね。
塩酸は酸性ですから電解質です。
塩酸と塩化水素の違いが分からない方はこちらをご覧ください。
あと、単純な金属は電解質ではありません。
でも塩化銅($CuCl_2 $)とか塩化鉄($FeCl_3 $)みたいに
『~+金属名』という物質は電解質になります。
それから砂糖などの有機物は非電解質ですけど
酢酸は例外的に電解質です。
ここまでは理屈で電解質と非電解質を見分ける方法でした。
以下は受験化学で出題されやすい電解質や非電解質なので
覚えておきましょう。
・塩化水素($HCl $)
・塩化ナトリウム($NaCl $)
・水酸化ナトリウム($NaOH $)
・塩化銅($CuCl_2 $)
・硫酸($H_2SO_4 $)
・砂糖(C12H22O11)
・エタノール(C2H6O)
などのアルコール類
・グルコース
・ショ糖
上記電解質と非電解質を覚えたらたいていの問題は解けるようになっているでしょう。
あとは問題で上記以外のものが出題されたら
その都度暗記カードや教科書に書き込んで
知識の幅を増やしていきましょう。
以上、参考になったようならうれしいです。