この記事では還元性を示すカルボン酸には
どんなものがあるのか?解説します。
還元性を示すカルボン酸
カルボン酸とは?

カルボン酸というのは上記のように書くことができます。

このC=Oになっている部分をカルボニル碁といいます。
O-Hの部分はヒドロキシ基、あるいはヒドロキシル基といいます。

そしてカルボニル基とヒドロキシ基を持っているということで
カルボキシル基とかカルボキシ基と呼びます。
そしてこのカルボキシル基(カルボキシ基)を持っている化合物のことをカルボン酸といいます。
ではカルボン酸にはどんなものがあるのでしょうか?
これからご紹介するカルボン酸の中に還元性のあるものがあるので
解説していきますね。
ギ酸
ギ酸はもっとも簡単なカルボン酸です。
蜂やアリなどが持っている毒です。
非常に強い酸性を示します。
ギ酸のギを漢字で書くと蟻(アリ)になります。
ギ酸は蟻酸と書くってことです。

このギ酸。
上記図のようにアルデヒド基がついています。
アルデヒド基には還元性があります。
なので、ギ酸は還元性があります。
また、ギ酸にはカルボキシ基もついています。
なので、ギ酸はカルボキシ基とアルデヒド基を
両方持っています。
酢酸

実験室の試薬びんの中にたいてい酢酸があります。
未開封な酢酸の試薬瓶を落としてぞっとしたとこ。割れなくて良かった。
— あ くず (@Akuz) June 15, 2010
冬に実験室にある酢酸を使って実験しようと
瓶を開けて出そうとすると、
液体が出てこないことが多いです。
固まっているのです。
私も大学の研究室にいたときにそんなことをよく経験しました。
酢酸の融点は16.6°C。
非常に高いですね。
だから冬場だと酢酸って凍っていることが多いのです。
カルボン酸は水素結合をするので整然と並んで結晶化することも
酢酸の融点=17℃
(純粋な酢酸=氷酢酸は結晶化する)— 分子模型bot (@chem_juken_bot) January 29, 2023
ということで寒い時の酢酸は固まっています。
そんな話があることから純粋な酢酸を『氷酢酸(ひょうさくさん)』といいます。
だから氷酢酸と書いてあってもただの酢酸のことなので
「???」とならないようにお願いします。
とうとう室内の氷酢酸も文字通り氷になってしまった。冬の到来だ。
私のラボでは、氷酢酸が凍ったら冬と認定している。 pic.twitter.com/jOxwZmbTXV— レイユール (@rayure_chemist) December 13, 2021
シュウ酸
シュウ酸は2価のカルボン酸です。
2価のカルボン酸とはCOOHを2つ持っているもののことです。
シュウ酸は以下のような構造をしています。

シュウ酸には還元性があります。
どういうことか?というとCOOHが電離します。
具体的には$H^{+} $が電離して出ます。

上の図をご覧ください。
$O^{ー} $がありますよね。
酸素って手が何本あるか知ってますか?
たとえば水の化学式($H_2O $)を思い出してください。
$H_2O $はHーOーHですから、
酸素には手が2本あるということがわかりますね。
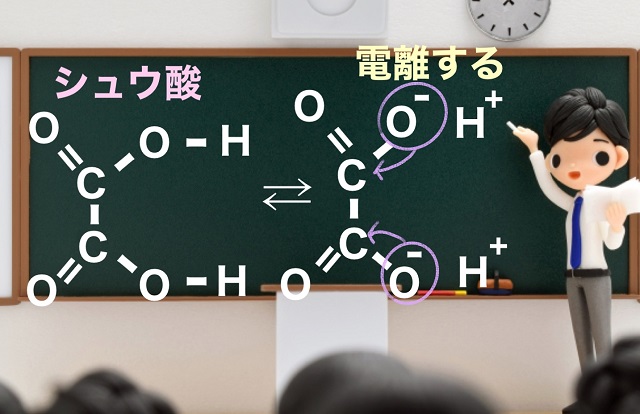
上の図の$O^{ー} $が
手2本でくっつきたいということで
隣のCとくっつこうとします。
OとCが新たに結合を作るわけですね。
新たにOとCの結合ができるとしても困ったことがあります。
新たな結合が増えたCですが、Cは結合の手が4本ですよね。
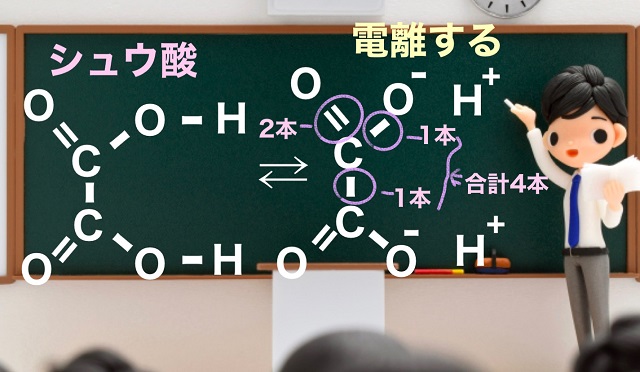
ただすでにC(炭素)は結合の手4本すべて使っています。

$O^{ー} $とCとの結合は5本目の結合ということになります。
でもCは結合の手が4本が限界。
ということでCの結合の手のうちどれか1本が切れないといけないわけです。
ではどうなるのでしょう?

結論としてはCとCの間の結合だけが切れます。
ちなみに結合の手というのはお互いに電子を出し合っている状態のことです。
お互いに電子を1個ずつ出すから、そこには電子が2個あるわけです。
CとCが結合していたときにも2個の電子がありました。
でもCとCの結合が切れたので、電子が2個余ることになりますね。
ではこの余った2個の電子はどうなるか?
外に飛び出すことになります。
以前解説しましたが
電子を放出する物質を還元剤といいます。
だからシュウ酸は酸化剤に向かって
電子を放出することができます。
なので、シュウ酸は還元剤としてふるまうことができます。
還元性を示すカルボン酸についてまとめ
ここまで解説してきたように
・ギ酸
・シュウ酸
でした。















