今回の記事では電気陰性度と極性について解説します。
電気陰性度と極性
電気陰性度とは?
まず電気陰性度という言葉自体がややこしいですよね。
一応前回の記事で覚えるべきポイントについて解説していますので
こちらの記事も参考にしていただけるとうれしいです。
⇒高校化学の電気陰性度の覚え方教えます!
電気陰性度はややこしい話ですが
知っておくといろんなことを考えながら
問題を解くことができるようになります。
なので記憶しておきましょう。
もう少し具体的に解説させていただきますね。
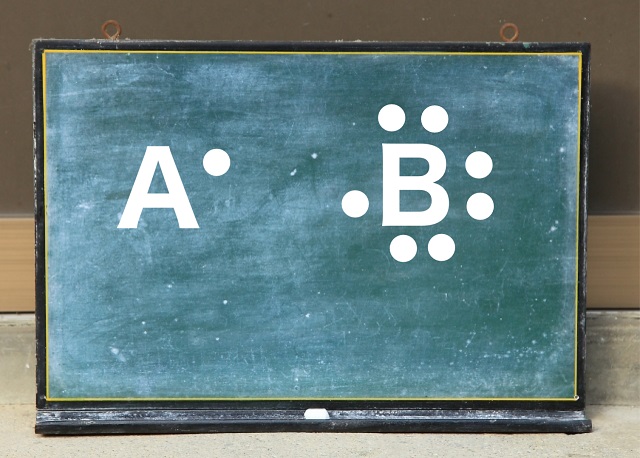
Aという原子が不対電子を持っているとしましょう。
不対電子についても前回の記事で詳しく解説しています。
⇒高校化学の電気陰性度の覚え方教えます!
Bという原子も不対電子を持っているとしましょう。
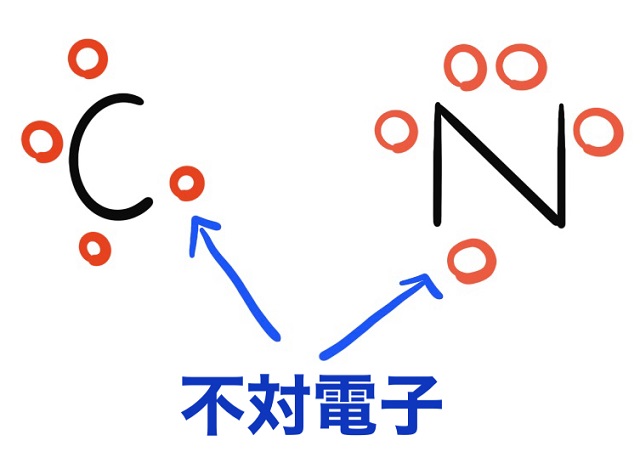
不対電子には寂しがり屋でくっつきたがる性質があります。
だからペアを作ろうとします。
このことを結合するといいます。
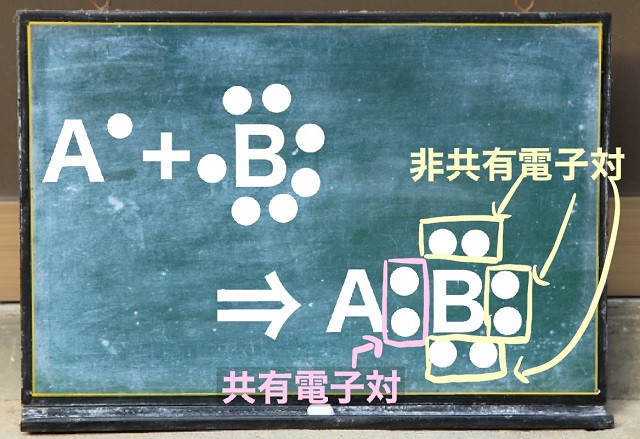
AとBがお互いに
不対電子を出し合ってペアを作ったとしましょう。
これが結合です。
するとAとBは新たにできたペア。
これをAとBにお互いに共有されている電子対ということで
共有電子対といいます。
これに対して共有されていない電子対を非共有電子対といいます。
これは英単語みたいなもので単純暗記の話です。
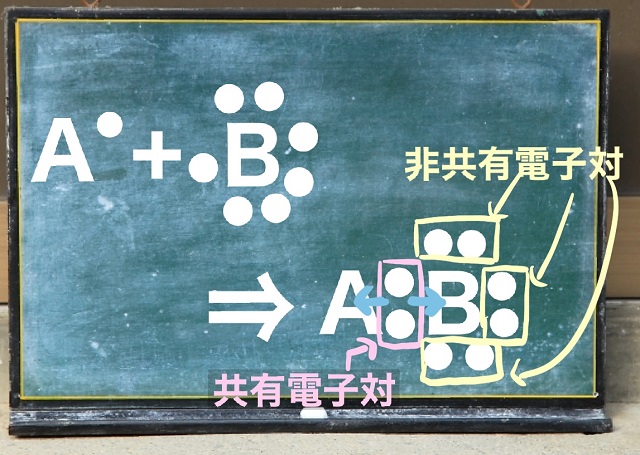
そしてAは共有電子対を渡したくありませんし
Bも共有電子対を渡したくありません。
お互いが引っ張り合いっこします。
どっちが引っ張り合いに勝つか負けるか
いちいち実験しながら研究するのは大変です。
だから昔の研究者はこの共有電子対を引っ張る強さを
数値化しました。
これを電気陰性度といいます。
共有電子対を引っ張る強さを数値化したものを電気陰性度といいます。
ここまでよろしいでしょうか?
化学結合には3つある
結合には3通りあります。
・金属と金属が結合する
・非金属と非金属が結合する
・金属と非金属が結合する
です。
非金属と非金属が結合する場合を共有結合といいます。
金属と非金属が結合する場合をイオン結合といいます。
金属同士が結合することを金属結合といいます。
まずはこの大枠は知っておいた方がよいでしょう。
共有結合と電気陰性度と極性の関係
水素Hは最外殻電子が1個で不対電子が1個です。
もちろん水素は非金属ですよ。

お互いに不対電子を出し合って水素原子と水素原子が結合しました。
すると水素分子になりますね。
水素分子を$H_2 $と書きますね。
最外殻電子がわからない方はこちらをご覧ください。
⇒価電子と最外殻電子の違いについてわかりやすく解説
⇒最外殻電子数の求め方を問題を使ってわかりやすく解説
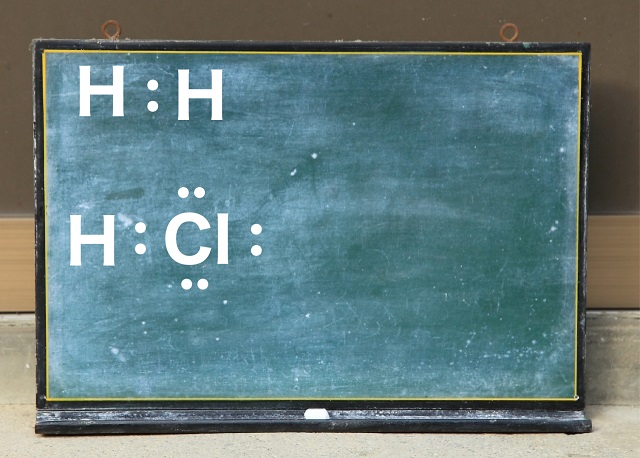
水素は最外殻電子が1個で不対電子が1個。
これに対して塩素Clは最外殻電子が7つで不対電子が1つです。
どちらも非金属なので共有結合します。
このように水素と水素が非金属同士
お互いに不対電子を出し合って結合して共有結合、
同様に水素と塩素もお互いに不対電子を出し合って結合して共有結合しています。
こんな感じで共有結合にはいろんなタイプがあります。
水素同士といった感じで同じ種類の非金属が結合することもありますし
水素と塩素みたいに違う種類の非金属が結合することもあります。
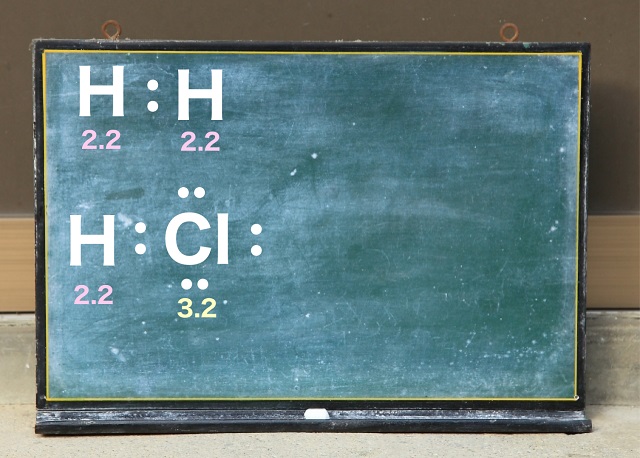
そしてポーリングさんが調べてくれた電気陰性度によると
水素の電気陰性度は2.2で塩素の電気陰性度は3.2です。
水素は2.2の力で共有電子対を自分によこせ!とやります。

なので水素分子の場合は引っ張り合いになります。
すると同じ力で逆向きに引きますから勝敗は永遠につきません。
鏡の中の自分と綱引きしているようなものですから。
だから電子対は真ん中でピタッと止まります。
これに退位して水素と塩素の場合は
2.2の力で水素は共有電子対を引きますが
塩素はもっと強い3.2の力で引きます。
すると水素は頑張りはしますが
さすがに塩素には叶いません。
塩素が『やや』勝ちます。
完全に勝敗はつきません。
でも、やや勝ちになります。
すると水素からすると自分の電子が失われている状況なので+
塩素からすると相手の電子がやってくるのでマイナスになります。
でも共有結合の場合、非金属同士のペアの場合には
どちらも電気陰性度が大きいので完全な勝敗がつかずに
やや負ける、やや勝つということでδ(デルタ)をつけます。
なのでδ+とかδーとなります。
このようにδ+、δーに分かれることを『分極する』とか『極性を持つ』
といいます。
これに対して水素分子は極性なしです。
こんな感じで水素のようにまったく極性を持たない分子のことを
無極性分子といいます。
これに対してHClのように分極していて
引っ張る力が残っているものを極性分子といいます。
毎回こんな風に電子を書くと段々面倒くさくなってきます。
ということで1個ずつ電子を出し合っているものは1本の棒で書きます。
これを価標といいます。
たとえば水素分子なら
H-H
となります。
HClなら
H-Cl
と書きます。
これを構造式といいますが
この構造式が大切なものになるので書きなれていってください。
発展形についてはこちらの記事で解説しています。
⇒構造式・示性式・分子式・組成式の違いを酢酸を例にわかりやすく解説