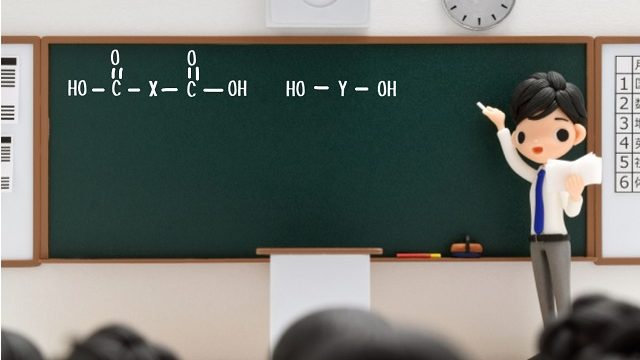・構造式
・示性式
・分子式
・組成式
の違いを酢酸を例にわかりやすく解説していきたいと思います。
構造式・示性式・分子式・組成式の違い
化学ではいろんな式がありますが、
その中に化学式というのがあります。
化学式には4つあります。
こういった基本を知らないと化学の勉強していると
必ず困ったことが起こります。
私も受験生時代そうでした。
⇒プロフィールと当ブログを作ることになったきっかけ
・構造式
・示性式
・分子式
・組成式
のことです。
この記事では酢酸を例に上記4つの化学式を示しつつ
違いについてもわかりやすく解説していきますね。
構造式の特徴
おそらくこの記事をご覧のあなたは酢酸は
よく知っていると思います。
酢酸は酸塩基などでしょっちゅう登場しますからね。
酢酸は1価の弱酸です。
たとえば以下の記事でも酢酸が登場します。
⇒酸塩基の価数に関する疑問を解決

そして酢酸は上のような構造をしています。
上記のように価標(かひょう)できちんと表したもの、
これを構造式といいます。
ちなみに価標とは原子間の結合を示す線のことです。
●単結合・・・一本の線
●二重結合・・・二本の線
●三重結合・・・三本の線
で表します。
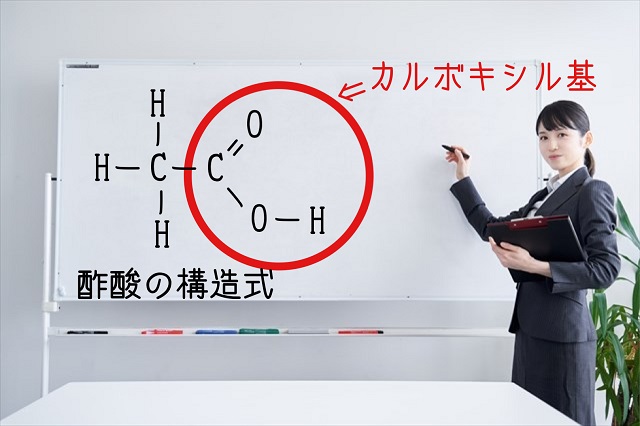
たとえば上記は酢酸の構造式ですが、赤丸の枠の中みたいなところに
注目してください。
赤丸の枠の中はカルボキシル基(あるいはカルボキシ基)です。
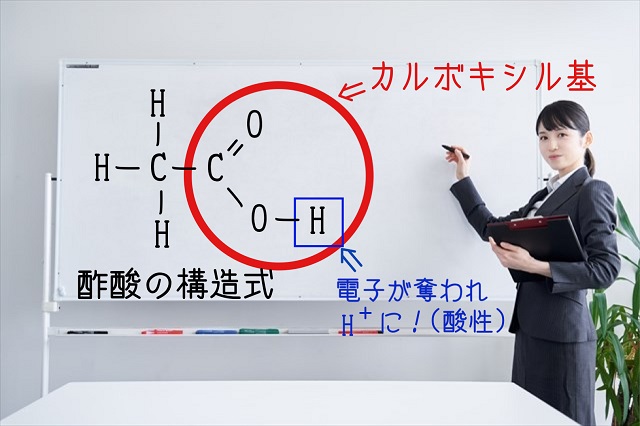
ところで、酸素Oは電気陰性度が大きく水素Hの電気陰性度は小さいです。
⇒電気陰性度とは?わかりやすく解説
しかも二重結合でくっついている酸素Oもいるので
水素Hの電子を引っ張り込みます。
そうすると水素原子は電子を酸素Oに奪われます。
結果、水素Hは$H^{+} $(水素イオン)になってしまうのです。
水素イオン($H^{+} $)といえば酸性です。
どうして$H^{+} $だと酸性といえるのか?
よくわからない方がこちらの記事をご覧ください。
⇒ブレンステッドローリーとアレニウスによる酸・塩基の定義の違いとは?
ところで酢酸は1価の弱酸でした。
以下の記事で酢酸のpHを計算しています。
⇒pHの計算方法について例題を使ってわかりやすく解説
とはいえ、計算しなくても構造式を見れば
性質まで一目でわかるわけです。
こんな感じで構造式は完璧な式といえるでしょう。
示性式と分子式の違い
よく間違えるのが示性式と分子式です。
示性式・・・$CH_3COOH $
分子式・・・$C_2H_4O_2 $
となります。
示性式はある意味分子式よりも立場が上です。
例えると示性式は部長で分子式は係長みたいな感じです。
どうして示性式の方が分子式よりも立場が上なのでしょう?
示性式は性質を示すからです。
性質がわかります。
なので構造式に準じるきちんとした式が示性式です。
たとえば酢酸の示性式は$CH_3COOH $です。
カルボキシル基($COOH $)が見えますね。
なのでパッと見て酸性だと性質まで全部わかってしまうわけです。
カルボキシル基が酸性だといえる理由は構造式のところで解説しています。
ところが分子式($C_2H_4O_2 $)だけみても
どんな性質があるのか?酸性なのかアルカリ性なのかわかりません。
カルボキシル基が見えないからです。
こんな感じで分子式というのは
それぞれの原子がいくつずつあるか?表しただけです。
これに対して示性式はもっとレベルが高いです。
つまり構造式に準じます。
たとえば酢酸にはカルボキシル基があるとすぐにわかります。
構造式・・・価標で表しながら性質もわかる完璧な式
示性式・・・構造式に準じる式で性質がわかる
分子式・・・それぞれの原子がいくつずつあるかしかわからない。
ということです。
組成式の特徴
ところで酢酸を分子式で表すと$C_2H_4O_2 $でした。
炭素が2個、水素が4個、酸素が2個です。
数学がわかる人なら理解できると思いますが
どれも2で割れますよね。
なので全体を2で割ると炭素が1個、水素が2個、酸素が1個になります。
よって組成式は$CH_2O $となります。
つまり組成式とはそれぞれの原子の比率だけを表した一番簡単なもののことです。
構造式・・・価標で表しながら性質もわかる完璧な式
示性式・・・構造式に準じる式で性質がわかる
分子式・・・それぞれの原子がいくつずつあるかしかわからない
組成式・・・それぞれの原子の比率だけを表した一番簡単なもののこと
はっきりいって組成式だけ見ても何のことだかさっぱりわかりませんね。
酢酸かどうかさえわかりません。
分子式だって一応酢酸の数はわかりますが、いまいちです。
示性式になると性質までわかります。
構造式になると完璧にいろんなことがわかります。
こんな感じで化学式は4段階(構造式⇒示性式⇒分子式⇒組成式)あるということを
よく理解しておきましょう。