今回の記事ではイオン結合の特徴についてわかりやすく解説していきます。
イオン結合の特徴
まずイオン結合ってどんな結合でしょう?
金属と非金属が結合したもののことでしたね。
ちなみに
・非金属と非金属(共有結合)
・非金属と金属(イオン結合)
・金属と金属(金属結合)
のでした。
詳しくはこちらで解説しています。
⇒共有結合とイオン結合の見分け方についてわかりやすく解説
そしてイオン結合からできている規則正しく並んでいるものをイオン結晶といいます。
それではイオン結合の特徴について解説しますね。
イオン結合の代表例としてNaCl(塩化ナトリウム)があります。
金属の$Na^{+} $非金属のと$Cl^{ー} $が結合しているからイオン結合の仲間です。

$Na^{+} $と$Cl^{ー} $という+とーが
規則正しく張り付いています。
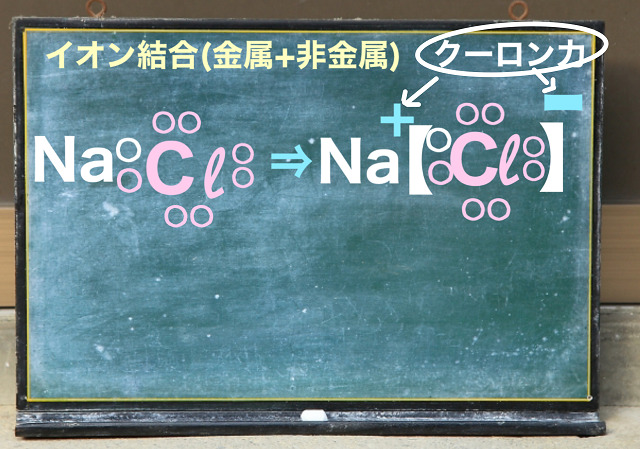
そしてこれらはクーロン力という力でくっついています。

上記図をご覧ください。
$Na^{+} $の周りに$Cl^{ー} $というマイナスがいっぱいいますよね。
一つ一つのクーロン力というのはそんなに強くありません。
でも、いろんなところでクーロン力が働いているので
かなり強くなってきます。
強い力っていうことは硬いということです。
人間でもマッチョな人の体って硬いと思いますが、
力が強いと硬くなるというイメージです。

では、上記図のようにハンマーなどで叩きました。
結果、1行ズレました。
イオン結合をズラしたらどうなるでしょう?

1行ズレるとプラスとプラス、マイナスとマイナスが出会いますね。
こんな感じで同じ符号のイオンが出会います。
同じ符号のイオンだと反発しますね。
反発するって言い方を変えるとものすごい勢いで離れようとしてるってことですよね。
さっきはクーロン力がいっぱい集まってすごい力になった結果、
硬くなったわけです。
でも、今度は真逆でみんなものすごい勢いで離れようとしています。
なので、壊れます。ということはもろいってことです。
ここまでまとめると
・クーロン力がたくさん存在するから硬い
・でも叩くと同じ符号のイオンが出会い反発するから壊れやすい(もろい)
です。

食塩の塊のことを岩塩といいます。
岩塩は硬いです。
なので軽く叩いても壊れません。

そしてある一定以上の力が加わってズレると
一気に壊れて粉々になってしまいます。
つまり『もろい』ってことです。
なんとなく想像できますよね?
塩の塊を触ったことがある方なら理解できるはずです。
またNaClという食塩ですが、
固体状態だとイオンが金属結合と違って止まっているので
電気を導きません。
ちょっと理解しにくいかもしれないので
金属結合と比較してみますよ。

金属結合の特徴は自由電子でした。
自由に動き回れるから自由電子です。

でもイオン結合は金属結合みたいに自由に動ける自由電子は存在しません。
だからイオン結合のイオンは自由でない、つまり止まっているわけです。
イオンってプラスとかマイナスと電気みたいな性質があるので
電気に関係してくるわけです。
「電気が流れる」みたいな表現がありますよね。
それってイオンが移動しているってことですよ。
イオンが移動するから電気が流れるわけです。
なんで私はトイレの電気を消せないんだろう🤨電気を消さなかったら身体に電気が流れるようにして欲しい。笑
— maho🦔 (@mh_2504) September 23, 2022
でも、固体状態であるイオン結合(イオン結晶)だとイオンは止まっているため、
電気を導きません。
ということで
・クーロン力がたくさん存在するから硬い
・でも叩くと同じ符号のイオンが出会い反発するから壊れやすい(もろい)
・固体だと電気を導かない
です。

そこでNaClを加熱してみましょう。
想像してみてくださいね。
フライパンに塩『だけ』入れて加熱します。
塩『だけ』加熱してもなかなか溶けません。
でもさらに加熱を続けます。
だいたい800℃くらいになってくるとドロドロNaClが溶け始めます。
加熱して溶けるときの温度を融点といいますね。
だからイオン結合は融点が高いという特徴があります。
融点が高い理由はイオン結合はもろいかもしれないけど、
クーロン力がいっぱいあるから結合力が強い点に起因しています。
・クーロン力がたくさん存在するから硬い
・でも叩くと同じ符号のイオンが出会い反発するから壊れやすい(もろい)
・固体だと電気を導かない
・融点が高い
そして高温で加熱してNaClが溶けると、
$Na^{+} $の周りに$Cl^{ー} $が動き回れるようになります。
固体状代だとクーロン力で強固に結合していたから
イオンが動けなかったわけです。
でも、加熱して溶けたら、結合が崩れているから
イオンが動き回れるようになるわけです。
ある意味金属結合の自由電子みたいな状態になります。
電子が動き回れるってことは電気を導けるってことです。
つまりイオン結合の場合、
溶けると電気を導くことができるという特徴があります。
固体でないならイオンが動けます。
ただの蒸留水だと電気を導きません。
でもNaClを蒸留水に溶かせばイオンが出てくるので電気を導きやすくなります。
ということでドロドロに溶けることを融解といいます。
融解液になったり、水に溶かして水溶液になったりすると
電気を導くことができるようになります。
・クーロン力がたくさん存在するから硬い
・でも叩くと同じ符号のイオンが出会い反発するから壊れやすい(もろい)
・固体だと電気を導かない
・融点が高い
・融解液や水溶液になると電気を導けるようになる
以上がイオン結合の特徴になります。
もしあなたが大学受験でイオン結合の特徴を勉強しているなら
単純暗記に頼らないでくださいね。
ここまで解説してきたように理屈で
イオン結合の特徴を説明しましたよね。
なので理屈を理解して
イオン結合の特徴を覚えていくようにしてくださいね。
以上で解説を終わります。














