今回の記事では「共有結合とイオン結合の見分け方がよくわからないよ!」
という方のために私が大学受験時代に得た知識をもとに解説します。
⇒当ブログ管理人のプロフィールはこちら
共有結合とイオン結合の見分け方
結合の仕方(くっつき方)にはいろんなパターンがあります。

たとえば商談が成立してお互い手を出しあって握手するとか。
こんな感じでお互いが自分のから手を出して握手するという場合もあります。

でも、片方の人が両手を出して相手に抱くつくようなくっつき方もあるわけですね。
また、先輩数人と後輩数人が同じ場所にいたとしましょう。
仮に握手するとなったら
・先輩同士で握手するパターン
・先輩と後輩で握手するパターン
・後輩同士で握手するパターン
の3パターンしかありませんね。
ところで、
・金属
・非金属
の2種類しかありません。
ということは先ほどの先輩と後輩の握手みたいに
・非金属と非金属
・非金属と金属
・金属と金属
の3パターンの握手(結合)しかないということが言えそうですね。
こういうパターン化がイオン結合か共有結合かを
見分けるときにすごく重要な考え方になってきますからね。
よーく理解しておいてくださいね。
では具体的にみていきましょう。
まず塩素(Cl)について考えてみましょうか。
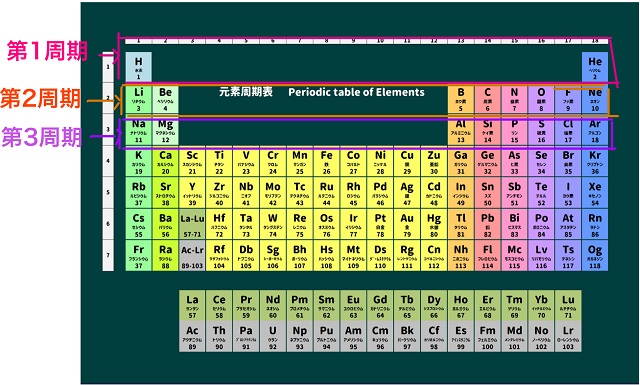
塩素は17番目にあります。
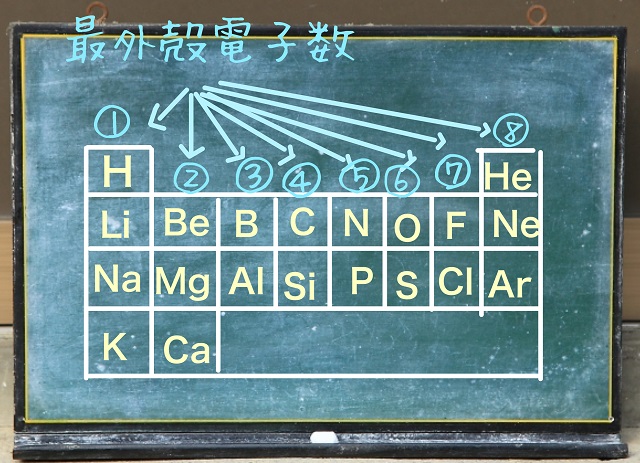
そして最外殻電子数は7ですね。
K(2)L(8)M(7)ですからね。

では電子式を書いてみましょう。
ポイントは最外殻電子の7個をできるだけペアを作らないように書くのでしたね。
すると上記図のように1個だけペアになってなくて残り3つはみんなペアができているという状態になります。
これが塩素原子の電子式になります。
ところで塩素というのは非金属になります。
それから水素Hはどうでしょう?
水素は電子1個の非金属です。
つまり水素Hや塩素Clは非金属です。
この非金属同士が握手(結合)したらどうなるでしょう?
お互いに非金属同士が手を出し合って握手(結合)する結合を共有結合といいます。
金属でないもの同士が結合するパターンが共有結合ってことです。
・水素H
・塩素Cl
があるので、これらの組み合わせで共有結合を作ってみましょう。

水素Hというのは最外殻電子が1個ですね。
ということは不対電子が1個ということ。
不対電子についてはこちらで解説しています。
・電子式で点の位置の注意ポイントとは?

では上記図の左上をご覧ください。
水素Hと水素Hがお互いに不対電子を出しあって結合したら共有結合になりますね。
だってお互い非金属だから。
ここで共有結合がイオン結合かを見分けるんですよ。
あとで解説しますが、イオン結合では非金属同士の結合にはなりませんからね。

では非金属である塩素Clはどうでしょう?
先ほども解説したように電子式は上記図のようになりますね。

すると、上記図の左下のように
HとClが結合しますし。
それから塩素同士が不対電子を1個ずつ出しあって結合すると
右上のようになります。
上記図の3つはみんな白色の〇とピンク色の〇を出しあって共有結合を作っています。
なぜなら非金属同士の結合だからです。
ということで共有結合には同じ種類(HとH、ClとCl)の非金属でくっついているものもあれば
違う種類(HとCl)の非金属でくっつくものもあります。
では次にイオン結合についてみていきましょう。
先ほど、結合には
・非金属と非金属(共有結合)
・非金属と金属(イオン結合)
・金属と金属
の3つしかないといいました。
金属と非金属の結合をイオン結合といいます。

たとえばナトリウムNaは金属です。
最外殻電子数は1になります。
先ほど塩素Clは非金属だといいましたね。
だから金属のNaと非金属のClの結合はイオン結合になります。
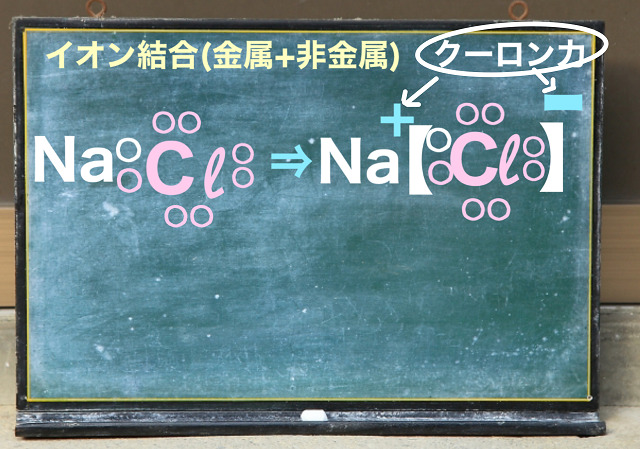
上記図の左側をご覧ください。
NaとClが不対電子を出しあって結合します。
ただ以前の記事で解説しましたが
最外殻電子が1個(Na)、2個(Mg)、3個(Al)のものは電子を
外に出して自分がプラスの陽イオンになりやすいです。
逆に最外殻電子が6個(酸素O)とか7個(塩素Cl)のものは
電子を受け取りやすいです。
電子を投げ捨てたい最外殻電子が1個から3個のものと
電子を受け取りたい最外殻電子が6個か7個のものがその場にいたら
お互いWinwinの関係になれます。
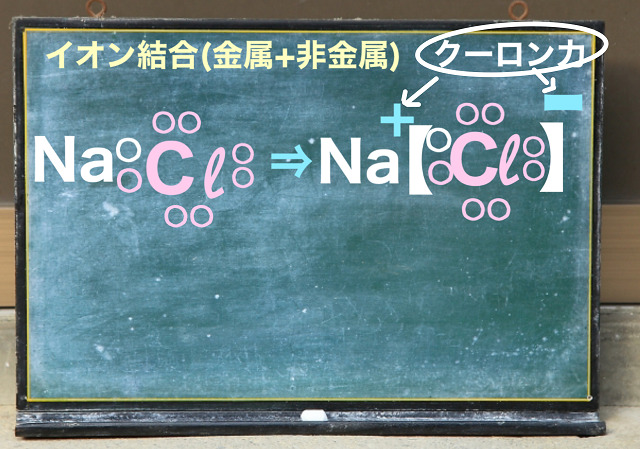
そしてそれが金属と非金属の結合の場合、
Naという金属は電子を1個投げて$Na^{+} $になり、
塩素Clは電子を1個受け取って$Cl^{ー} $となります。
これが上記図の右側になります。
こんな感じで電子を投げたいという
Naと電子を受け取りたいというClの組み合わせがイオン結合です。
以前解説した最外殻電子とイオンの関係の記事はこちら
・最外殻電子とイオンの関係をわかりやすく解説

ここまで解説した内容がしっかり理解できると
逆にこんな疑問がわいてくるかもしれません。
「共有結合の水素Hと塩素Clだって水素Hが電子を1個投げたいし
塩素Clは電子1個受け取りたいからイオン結合なんじゃないの?
こうなったらややこしくて共有結合とイオン結合を見分けれないじゃん!」って。
自暴自棄に陥った方もいるかもしれませんね。
確かに水素H同士だったら電子を投げたい同士だから
明らかにイオン結合ではないですね。
イオン結合だったら電子を投げたいものと受け取りたいものの結合ですからね。
また塩素Cl同士の結合も電子を受け取りたいもの同士の結合だから
やはりイオン結合ではないことくらい簡単に見分けがつくようになったでしょう。
でもHとClの組み合わせだけはややこしいですね。

確かにHは電子を投げたいし、Clは電子を受け取りたいわけです。
でも、Hを含む非金属というのはNaなどの金属と比べると電子を投げたいという
パワーがちょっと弱くなります。
なので、言葉で表現するとしたら
非金属のHは『ちょっと』電子を投げたいし非金属のClは『ちょっと』電子を受け取りたいとなります。

そして化学では『ちょっと』とか『やや』を表す記号に『δ(デルタ)』があります。
上記図の左下のようにHは電子をちょっとあげるのでδ+となり
Clはちょっと電子をもらいたいのでδーとなります。
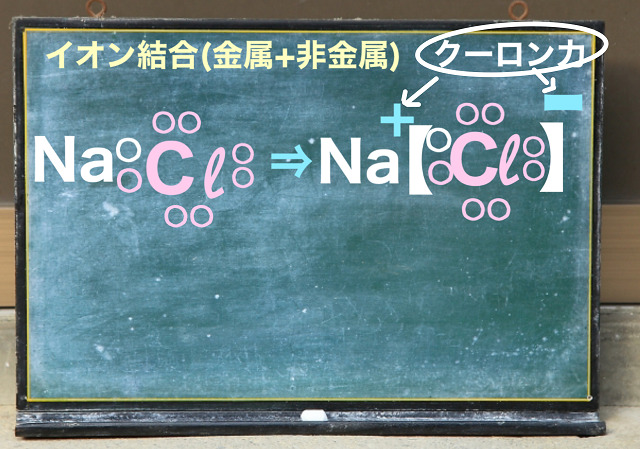
共有結合のδ+、δーに比べて
金属、非金属の組み合わせであるイオン結合の場合は
Naは完全に電子をあげるのでδ+でなく+となります。
共有結合のときδーだったClも相手が金属の場合はδーでなくー(マイナス)になります。
こんな感じでイオン結合の場合は中途半端でなく明確に
電子を出したり受け取ったりするわけですね。
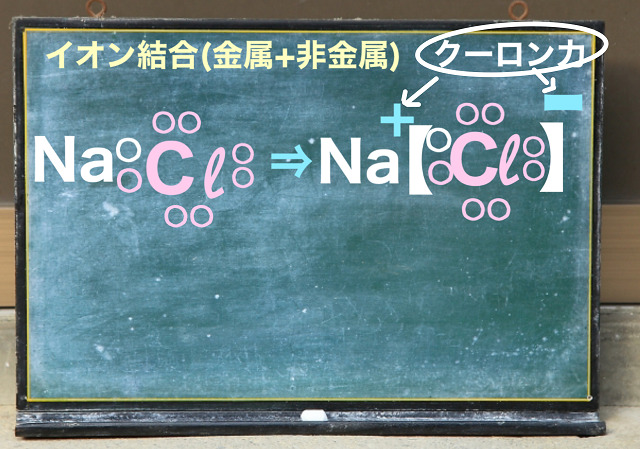
だからイオン結合の場合、完全に電子のやり取りが行われるので
上記図の右上のようにプラスとマイナスになります。
そしてプラスとマイナスができると磁石や電気みたいに
引力が働きます。
このプラスマイナスの引力の事を『クーロン力』といいます。
以上のようにイオン結合と共有結合を見分ければOKです。

ちなみに金属同士の結合を金属結合といいます。
ナトリウムは金属でしたね。
そこでナトリウム同士の結合を考えてみましょう。
Na同士ですからどちらも電子を投げたいわけです。
どちらも電子がいらないわけです。
となると人間の家庭でもそうなるでしょうけど放任主義になります。
結果、電子は自由に動き回ります。
だからこの電子を自由電子といいます。
ということで金属というのは
自由きままに電子が動くので電気を導きます。
以上で解説を終わります。















