ボルタ電池の仕組みと欠点についてわかりやすく解説
ボルタ電池の仕組みと欠点
メインは具体的なボルタ電池の仕組みや欠点について解説していきます。
ですが、一番最初は電池の仕組みについて先に解説します。
電池の仕組み
電池とは電気がいっぱい入っている缶詰ではありません。
キョロちゃんの缶詰??
電池入れる缶詰???
それは最早缶詰ではないのでは?ww
#生乾き795 #橋爪もも— Mack5サブ垢チャレンジ (@Domo2Mack5death) March 5, 2023
まず酸化剤、還元剤って聞いたことがありますか?
⇒酸化剤と還元剤語呂を使った覚え方
酸化剤、還元剤というと酸化還元反応ですよね。
⇒酸化還元反応式の作り方についてわかりやすく解説

電池というのは酸化還元反応を利用してできています。
電子を受け渡しするというのが酸化還元反応でした。
⇒酸化還元反応式の作り方についてわかりやすく解説
酸化還元反応というのは電子の受け渡しでした。
実はそのときにエネルギーが出るのです。
エネルギーといっても多くは熱が出ます。
なんかもったいないですよね。
どうにかしてそのエネルギーを利用できないか?
と考えるわけです。

どうにかして酸化還元反応で出てくるエネルギーを横取りできないか?
ということを考えます。
どうすればいいか?
酸化剤、還元剤を引き離しましょう。
そして間を上記図のように導線で結びます。
いわゆるリード線です。
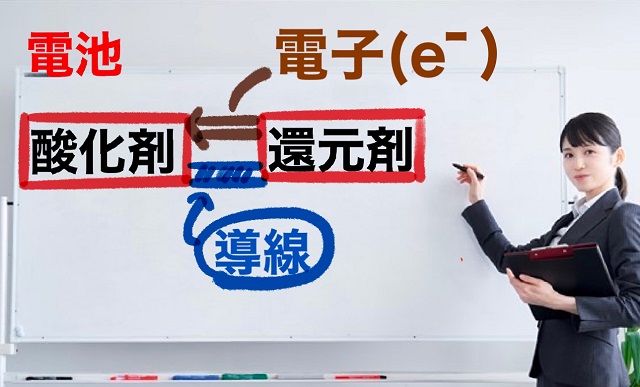
酸化かげんなので電子の受け渡しが当然あります。
電子は導線の中を通っていきます。
これは酸化還元の基本ですよね。
⇒酸化還元反応式の作り方についてわかりやすく解説
電子を導線を伝って通すことによって
エネルギーを横取りできます。
こういう装置を電池といいます。
酸化還元反応だと直接電子を受け渡してしまいます。
するとエネルギーを横取りできません。
なので、酸化剤、還元剤を引き離し導線で結んであげます。
そして導線を伝って電子を通すようにするわけです。
するとそこに電球をつけるとピカッと光ったりします。
こういう装置を電池といいます。
なので電池は酸化還元なのです。
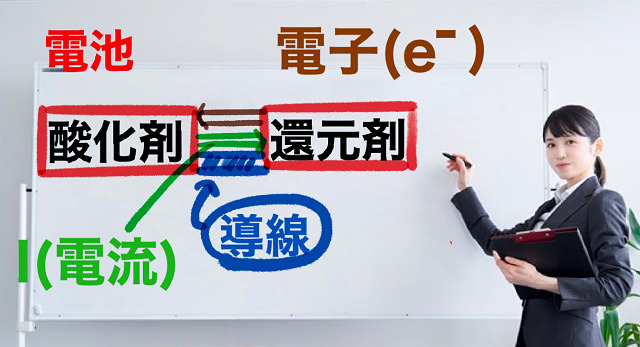
電子はマイナスの電気です。
なので、逆向きに電流(I)が流れます。
私たちが普段、電流と呼んでいるものは
本当は電子です。
電子が逆向きに流れていました。
でも勝手に学者が電流の向きを(上記図だと右方向に)決めてしまいました。
そしたら実際は電子は逆向きに(上記図だと左方向)流れていたのです。
しかたがないから電子をマイナスと決めたのです。
要するに電子と逆向きに電流が流れるということになってしまったわけですね。
これから具体的にボルタ電池の仕組みについて解説していきます。
ですが、電池の概念というのはここまで解説してきたとおりです。
ボルタ電池の仕組み
さて具体的にボルタ電池の仕組みについて解説していきますね。
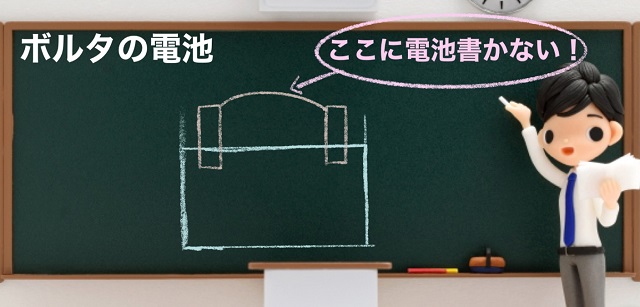
上記図がボルタ電池です。
上記図のように導線上に電池を書く人がいます。
でもダメですよ。
電気分解ではありませんから。
自分自身が電池です。
ですので、導線のところに電球とか使うものを書く必要があるときは書くようにしましょう。
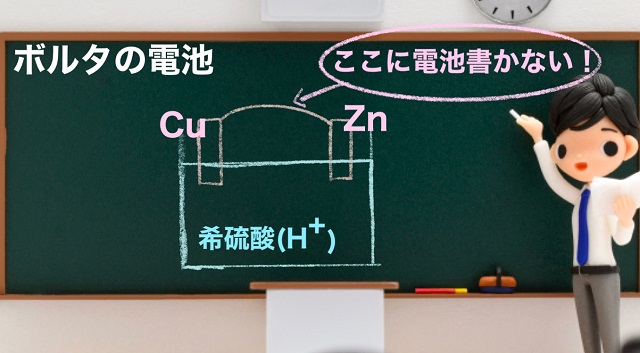
そして希硫酸に銅板(Cu)と亜鉛板(Zn)を浸します。
電解液は希硫酸は酸です。
なので水素イオン($H^{+} $)です。
⇒酸塩基の見分け方についてわかりやすく解説
アレニウスの定義は水に溶けて$H^{+} $を出すのが酸ですからね。
⇒ブレンステッドローリーとアレニウスによる酸・塩基の定義の違いとは?
さてここからストーリーが始まります。
Znはイオン化傾向が$H^{+} $より大きいので溶けます。
でもCuはイオン化傾向が$H^{+} $より小さいので溶けません。
⇒イオン化傾向が大きいほど何がいえるか?

Znがどんどん溶けていきます。
ただZnが全部溶けるか?というとそんなことはありません。
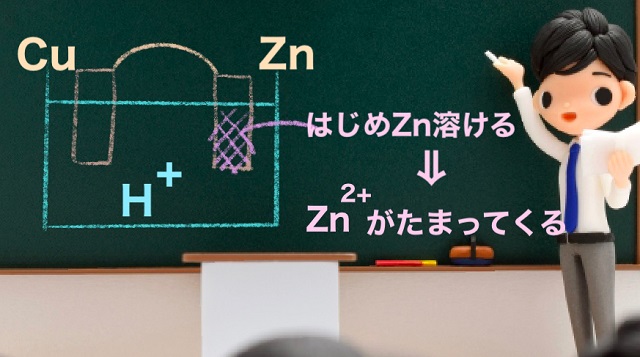
はじめは確かに$H^{+} $(水素イオン)がZn(亜鉛)をどんどん溶かします。
溶けたら亜鉛イオン($Zn^{2+} $)になります。
だから上記図のように亜鉛イオン($Zn^{2+} $)がたまっていきます。
すると、困ったことが起こります。
何が困るのでしょう?

$H^{+} $(水素イオン)はZnを溶かそうと近づいていくわけです。
でも、周りに亜鉛イオン($Zn^{2+} $)がいっぱいたまっているので
ブロックされてしまうのです。
なので$H^{+} $(水素イオン)はZnに近づけなるわけです。
$H^{+} $(水素イオン)は困ってしまいます。

困った$H^{+} $(水素イオン)はCu(銅)の方に行きます。
ただCuはイオン化傾向が水素より小さいです。
だからCuは希硫酸(水素イオンと同じ意味)には溶けません。
⇒イオン化傾向が大きいほど何がいえるか?
$H^{+} $(水素イオン)とCuは反応しないのです。
ただCuは金属です。
金属結合(金属結晶)のところを復習していただければわかると思いますが、
金属は電子の流れをサポートできます。
⇒金属結晶とイオン結晶の性質の違い
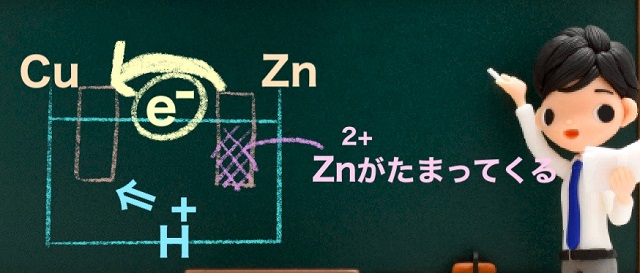
具体的には導線を伝って電子を欲しがっている$H^{+} $(水素イオン)がいるので
電子($e^{ー} $)がZnからCuに流れます。
すると銅板の表面では
以下のような反応が起きています。
$2H^{+} $+$2e^{ー} $⇒$H_2 $
と、$H^{+} $(水素イオン)が
$e^{ー} $(電子)をありがたく受け取るわけです。
おかげで水素イオンはめでたく水素ガスになることができました。
こんな感じで銅板の表面で電子を受け取るわけです。
そして亜鉛板の表面ではどういう反応が起きているのでしょう?
思い出してください。
さきほど、亜鉛イオンが水素イオンをブロックしていましたね。
$Zn $⇒$Zn^{2+} $+$2e^{ー} $
とひたすら亜鉛は溶けて亜鉛イオンになっていきます。
亜鉛版の導線から電子をどんどん奪われていくわけです。
だから亜鉛板の表面から水素の攻撃をブロックできたとしても
中から導線経由で電子を持っていかれてしまいます。
だからひたすら亜鉛は溶けて亜鉛イオンになっていきます。
残念な亜鉛です。

電子は上記図のように流れています。
亜鉛から電子が出て、
その電子が導線経由で銅板の表面の水素イオンに渡されるわけです。
ということは電流は逆向きです。
CuからZnの方に流れるということです。
これはボルタ電池でなく電池の仕組みのところで解説していますよ。
この記事の上の方をご覧ください。
ところで電流は電池のプラスから出ます。
【電気の知識】
~ 電流と電子の流れる向きは逆 ~“電流が流れる”とは、導体の中を自由電子が動くこと。でも電流と電子の流れる向きは逆。
理由は、
①電流発見!
②「電流は電池のプラスからマイナスに流れる」と決定
③その後に電子発見!
④あれ、電流の正体って電子!? しかも向き逆じゃん! pic.twitter.com/teCjGylZwT— とき@engineer (@toki_engineer) December 11, 2020
つまり銅板が+極で亜鉛板がー極だということです。
ところで先ほど示した式は半反応式です。
⇒半反応式の問題を解きながら作り方も覚えよう!
Cu:$2H^{+} $+$2e^{ー} $⇒$H_2 $
Zn:$Zn $⇒$Zn^{2+} $+$2e^{ー} $
ですので電子を消去してあげるとイオン反応式が導けます。
この辺はこちらの記事で詳しく解説しています。
⇒酸化還元反応式の作り方についてわかりやすく解説
つまり以下のようなイオン反応式が導けます。
$Zn $+$2H^{+} $⇒$Zn^{2+} $+$H_2 $↑
上記式になります。
Znが溶けて$H_2 $↑(水素ガス)が発生します。
結局は亜鉛を希硫酸に溶かしたということになるわけです。
ただ、亜鉛と銅を引き離しているから
今回の記事のように電流を得ることができ、電池になるわけですね。
上記イオン式の作り方はこちらの記事で
詳しく解説しています。
⇒イオン化傾向が大きいほど何がいえるか?
ボルタ電池の欠点
ボルタ電池には欠点があります。

銅板の表面に水素の泡がたまってしまうのです。
Cu:$2H^{+} $+$2e^{ー} $⇒$H_2 $
Zn:$Zn $⇒$Zn^{2+} $+$2e^{ー} $
半反応式を見れば明らかですね。
こんな感じで泡がいっぱい銅板につきます。
泡って気体ですね。
なのでイオンが通れません。
水溶液中ならイオンは移動できます。
でも、気体になるとイオンが通れません。
なので銅板の表面に水素の泡ができると効率が悪いです。
結果、突然電流が流れにくくなることがあります。
これを分極といいます。
そんなこともあるので水素の泡を取ってあげる必要が出てきます。
たとえば割り箸でこするって手もあるでしょう。
ですが化学的には減極剤を利用して水素の泡を取ります。
減極剤(げんきょくざい)の目的は
分極を防ぐことにあります。
・ニクロム酸カリウム
・過酸化水素
などを使います。
水素の泡が邪魔でしょうがないってことです。
これを溶かしたい。
この目的を達成するために減極剤があります。
水素ガスそのものは水には溶けにくいです。
ではどうしたらいいか?
イオンにしたらいいです。
具体的には以下のような反応式になります。
イオンなら水に溶けるからです。
$H_2 $⇒$2H^{+} $+$2e^{ー} $
水素イオンというイオンなら水に溶けやすいです。
なので水素ガスを溶かすためにイオンにするわけです。
これが基本的な発想です。
$H_2 $⇒$2H^{+} $+$2e^{ー} $
つまりイオンにするためには電子を奪えばよいわけです。
そこで使うのが減極剤(二クロム酸カリウムや過酸化水素)を使います。
二クロム酸カリウムや過酸化水素は酸化剤です。
電子を取らないといけないから酸化剤を使うのです。
⇒酸化剤と還元剤語呂を使った覚え方
続いて濃淡電池について解説します。
⇒濃淡電池の仕組みと反応式についてわかりやすく解説















