今回の記事では共有結合とは何か、
簡単に説明したいと思います。
ただ、先に前回の記事の復習をしましょう。
でないと、いくら簡単に説明しようとしても難しく感じてしまいますから。
前回の記事では不対電子は不安定な状態と説明しました。
⇒電子式書き方の決まりをわかりやすく解説

これに対してペアになっている電子を電子対で安定しているといいました。
⇒電子式書き方の決まりをわかりやすく解説

特に上記のように他の原子と関わらずにもともとの自分の最外殻電子で作った電子対です。
こういうのを他の原子と共有していないので、非共有電子対といいます。
非共有電子対はすごく安定な状態です。
不対電子はすごく不安定な状態。
なんとかして電子対という形を作りたいのです。
どうやったら電子対の状態を作れるでしょう?
2つ方法があります。これが共有結合につながります。
共通結合とは?簡単に説明します
不対電子が電子対になる方法の1つ目は
他から電子をもらってくるという方法です。

たとえば酸素原子には不対電子が2つありますね。
でも他から電子を2つをもらってくれば、全部電子対の形になりますね。

もちろん、この場合全体としてはマイナス2という電荷になりますね。
なぜならマイナスの電子を2個受け入れたからです。
もともとあった状態に対して電子2個増えたからマイナス2になります。

これを2価の陰イオン(酸化物イオン)といいます。
これがイオンで、このようになることをイオン化するといいます。
イオン化することによって不対電子をなくして安定化することができます。
でも、イオン化することができる原子もあれば
イオン化できない原子もあります。

たとえば、炭素原子。
炭素原子は電子をもらって不対電子をなくそうと思ったら
あと電子が4個必要です。
もらわないといけない電子の数が多すぎます。
1個、2個だったらやりとりできるけど、
3個、4個電子を貰おうとすると「クレクレ君」みたいになってしまい
嫌われるため、イオン化することで、自分の不対電子を処理することができません。
では不対電子をなくす方法が他にあるのでしょうか?
不対電子同士で連結すればよいわけです。
他の原子が持っている不対電子と自分の持っている不対電子、
不対電子同士で連結すれば電子対になりますね。
これが共有結合です。
自分の持っている不安定な不対電子と他の原子が持っている不安定な不対電子を
連結させて安定な電子対を作るという発想で生み出される結合が共有結合です。
共有結合とは不対電子同士を出し合って、
共有電子対を作る結合のことです。
他にもいろんな化学結合がありますが、
共有結合がもっとも強い結合です。
結びつきが一番強いです。
切れにくいという意味になります。
共有結合の例
共有結合の例を挙げましょう。
$H_2 $分子を例に考えていきますね。
Hが2個あるので、電子式にすると以下のようになりますね。

この不対電子同士をお互いに提供し合って連結させましょう。
そして電子対を作ります。
こちらの図の右側が完成した電子対になります。
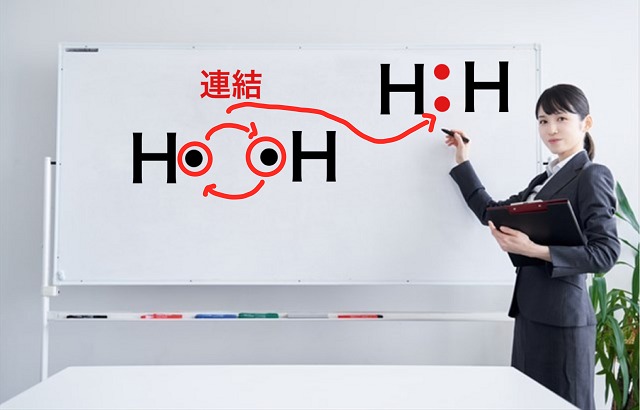
これが共有結合であり、共有電子対といいます。
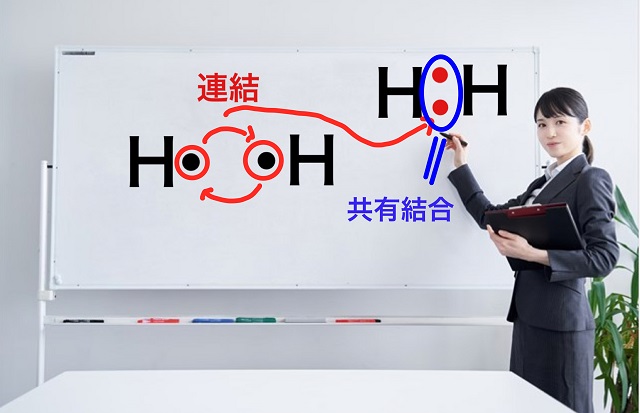
これが水素分子の電子式です。
2つ目の例として水($H_2O $)分子を考えてみましょう。
酸素原子1つに対して水素が2つで連結するわけですね。

酸素の持っている不対電子と水素の持っている不対電子が連結して
共通結合が作られます。

結果、水分子が出来上がります。
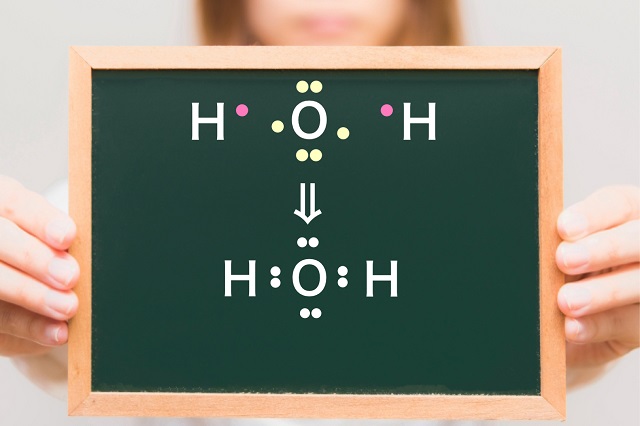
こんな風にして共有結合が出来上がります。
で、ここまでは1個ずつ電子を出し合う結合を例にしてみましたが
いつも1個ずつ不対電子を出すとは限りません。
2個ずつとか3個ずつ不対電子出してできる分子もあります。
複数の不対電子を出してできる結合例
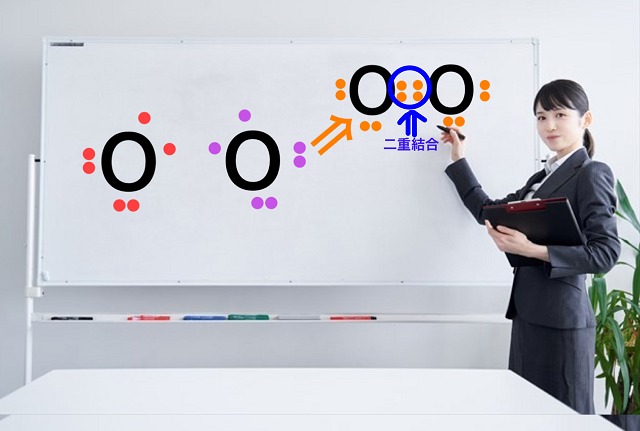
たとえば酸素分子($O_2 $)を考えてみましょう。
酸素分子は酸素原子2つでできます。
電子式を書いてみますと、
(不対電子がお互いお見合いする感じで書いてみましょう)

となりますね。
酸素原子の最外殻電子数は6個ですからね。
なので、酸素は不対電子を2個持っています。

ということは1個ずつ不対電子を出し合ったら
不対電子が1個ずつ残ってしまいますよね。
でも、不対電子が残らないように結合を作らないといけません。
不対電子は不安定で、電子対は安定ですからね。
不安定なものは安定になりたがりますから
どうにかして酸素原子に存在する不対電子をなくしたいわけです。
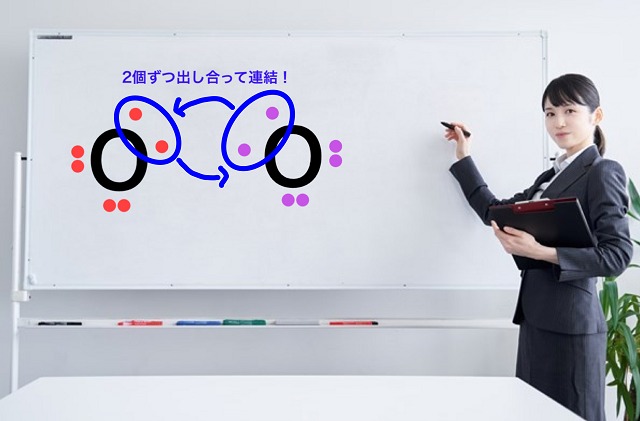
そこで2個ずつ出し合って連結することで
不対電子をなくします。
したがってこういう共有電子対になります。

これを二重結合といいます。
2個ずつ不対電子を出し合ってできた結合のことを二重結合といいます、
他にも例として窒素分子($N_2 $)は3個ずつ不対電子を出し合って三重結合になります。
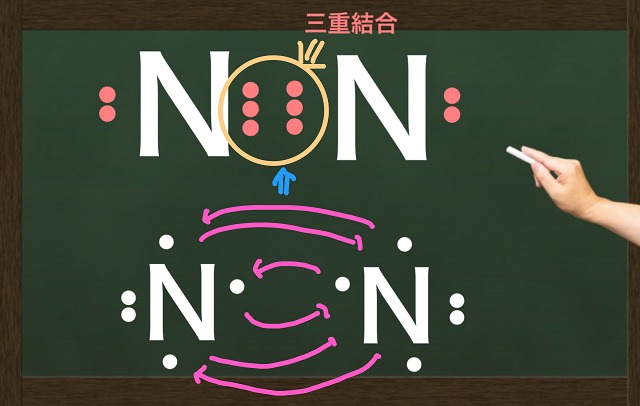
三重結合はものすごく強力です。
1個ずつ出し合ってできた結合を単結合といいますが、
単結合より、2個ずつ出し合ってできた二重結合の方が結合力が強力です。
さらに二重結合より3つずつ不対電子を出し合ってできる三重結合の方が結合力は強力です。
結合力が協力という事は切れにくく、安定しているということです。
ちなみに窒素分子は希ガスに近いくらい安定した性質を持っています。
窒素分子は空気中に存在するよくある分子です。
でも、すごく切れにくく安定しています。
そこで窒素分子をなんとかして化学反応させることはできないか?
研究者はいっぱい研究してきました。
今は窒素分子からアンモニアという分子を作ることができます。
アンモニアから肥料を作り、植物が育ち
食べ物が増えました。
人類の英知ってすごいものですね。
最後にポイントを共有結合を作る時のポイントは
不対電子が残らないように作るというところです。
続いて共有結合を構造式で表す方法について解説します。
⇒化学に登場する構造式とは?例を挙げながらわかりやすく解説
また、共有結合結晶について知りたい方はこちらをご覧ください。
⇒共有結合結晶とは?わかりやすく解説















