今回の記事ではヨウ素とチオ硫酸ナトリウムの化学反応式を示した後、
指示薬は何を使うのか?わかりやすく解説します。
ヨウ素とチオ硫酸ナトリウムの化学反応式
ヨウ素にチオ硫酸ナトリウムを加えます。
ただ、ヨウ素は水には溶けません。
だからヨウ化カリウム水溶液に溶かしたりと面倒くさい操作が必要になります。
チオ硫酸ナトリウムも水溶液として使います。
説明しよう!ヨウ素は元々固体で、昇華性(ドライアイスと同じ)を持っているんだ!だから水にあまり溶けない…でもヨウ化カリウムにすると溶解性を持つようになり、水でも溶けるようになるんだ!
— すぺりおる🌽🛸💜⚓️📜📕 (@ExSSUWAKO) May 28, 2022
では化学反応式を書いていきますよ。
チオ硫酸ナトリウムはチオ硫酸イオン($S_2O_3^{2ー} $)でまず考えます。
酸化還元反応式(化学反応式)の場合、半反応式から考えるのでしたね。
よくわからない方はこちらをご覧ください。
⇒酸化還元反応式の作り方についてわかりやすく解説
⇒半反応式の問題を解きながら作り方も覚えよう!
(1)$I_2 $+$2e^{ー} $⇒$2I^{ー} $
(2)$2S_2O_3^{2ー} $⇒$S_4O_6^{2ー} $+$2e^{ー} $
です。
次に電子を消す作業に入ります。
ヨウ素の方もチオ硫酸イオンの方もどちらも電子数が2($2e^{ー} $)なので
普通に計算が可能です。
(1)$I_2 $+$2e^{ー} $⇒$2I^{ー} $
(2)$2S_2O_3^{2ー} $⇒$S_4O_6^{2ー} $+$2e^{ー} $
より、(1)+(2)をすると
$I_2 $+$2S_2O_3^{2ー} $⇒$2I^{ー} $+$S_4O_6^{2ー} $
となりますね。
上記計算が分からない方、
こちらの記事で5000文字使って懇切丁寧に解説していますのでご覧ください。
⇒酸化還元反応式の作り方についてわかりやすく解説
$I_2 $+$2S_2O_3^{2ー} $⇒$2I^{ー} $+$S_4O_6^{2ー} $
で、今回はチオ硫酸ナトリウムとヨウ素との反応でした。
$2S_2O_3^{2ー} $と2-(2マイナス)に
なっていて係数が2なのでナトリウムイオン4つ必要ですね。
ただ、左辺だけナトリウムイオンを加えると
両辺のバランスが崩れますよね。
たとえば2+4=6という式があって
左辺にだけ4加えると、
2+4+4=6
となり、おかしいですよね。
だから両辺に+4して
2+4+4=6+4=10とバランスとれますね。
これと同様に
$I_2 $+$2S_2O_3^{2ー} $⇒$2I^{ー} $+$S_4O_6^{2ー} $
の両辺に$Na^{+} $(ナトリウムイオン)を4つ加えましょう。
すると、
$I_2 $+$2Na_2S_2O_3 $⇒$2NaI $+$Na_2S_4O_6 $
となります。
とりあえず化学反応式が出来上がります。
ヨウ素とチオ硫酸ナトリウムの反応で使う指示薬は何?
中和滴定って覚えてますか?
中和滴定に似たものに酸化還元滴定があります。
イメージ湧きますか?
中和滴定というのは酸と塩基でしたね?
そしてわからない相手の濃度を求めるのでした。
酸化還元滴定も相手の濃度を求めるのですが
この場合は、酸化剤と還元剤で滴定します。
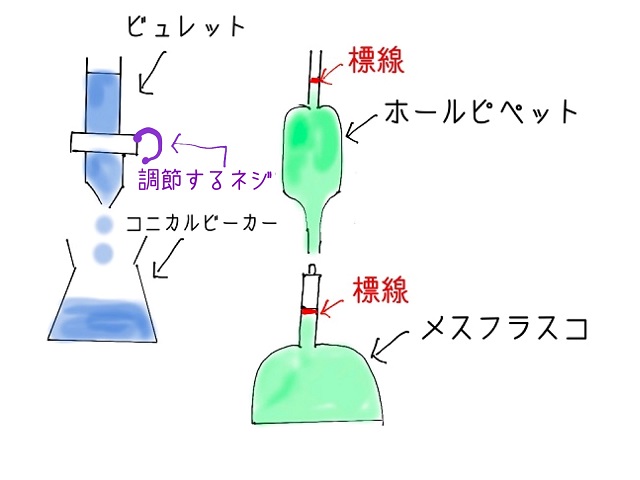
つまり、コニカルビーカーに相手を入れておいて
上からビュレットで酸化還元反応をやることによって
相手の濃度を決めるわけです。
中和滴定と同じような器具を使って酸化還元滴定を行います。
たとえばヨウ素をチオ硫酸ナトリウムで中和滴定することはよくあることです。
当然、指示薬が必要ですね。
指示薬は何を使えばよいのでしょう?
結論としてはヨウ素分子($I_2 $)に対して反応はしますが
ヨウ化物イオン($I^{ー} $)に対しては知らんぷりというある指示薬を使います。
ではヨウ素分子($I_2 $)は何に反応するのでしょうか?
答えはデンプンです。
ヨウ素分子($I_2 $)の場合、
デンプンを指示薬に用います。
デンプンとヨウ素で青紫色って聞いたことありますよね。
ヨウ素デンプン反応ですね。
大学生にもなってヨウ素デンプン反応でキャッキャしてるの俺だけ説 pic.twitter.com/khuiCHBzLp
— たにぜん (@tani_53_su) December 5, 2022
$I_2 $+$2Na_2S_2O_3 $⇒$2NaI $+$Na_2S_4O_6 $
ですからデンプンを加えていると
ヨウ素($I_2 $)がいる間は青紫色になります。
逆にヨウ化物イオン($2NaI $など)だとデンプンはまったく反応しません。
なのでヨウ素がなくなったところで
青紫色がパッと消えるのです。
だから「ヨウ素が今消えたな」って視覚的に把握できるわけです。
なのでヨウ素というと
小学校で「ヨウ素にデンプンを加えると青紫色になる」と
聞いたことがあるでしょう。
これの応用ですね。
デンプンを指示薬にして最初は青紫色をしているわけですが、
ヨウ素が全部反応したら青紫色が消えます。
だから「ちょうど反応が終わった」とわかるわけです。
こんな指示薬の使い方もあるんだということも
知っておいて損はないでしょう。
以上で解説を終わります。