前回の記事では原子の構造について解説しました。
ここでは中性子とか陽子とか電子についても詳しく説明しました。
⇒原子の構造について図を使ってわかりやすく解説
ところで陽子の数はいつも同じ数だけ存在しますが、
中性子の数はいつも同じ数があるわけではありません。
ということは同じ種類の原子(例:炭素CとかヘリウムHeとか)でも、
中性子の数が1個増えたり、1戸減ったりすることはあり得るということです。
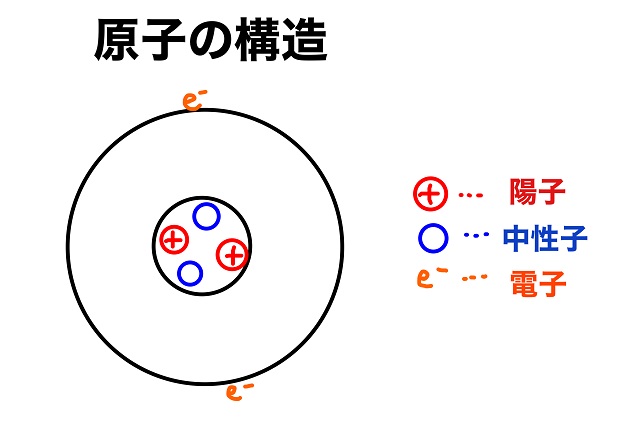
上記画像はHe(ヘリウム)ですが、もし中性子の数が1個増えたら
質量数は5になりますね。
「よくわからない」という方は、先にこちらの記事を見てください。
⇒原子の構造について図を使ってわかりやすく解説
ここでは理屈抜きに結論だけ言っておきますと、
質量数=陽子の数+中性子の数
ですから、Heは原子番号が2だから陽子数が2で中性子は2から1個増えて3個なので
質量数=2+3=5
となります。
逆に中性子数が2個から1個減ったらどうなりますか?
質量数=2+1=3
となりますね。
同じヘリウムという原子でも
原子番号が2だから絶対に陽子の数は2個です。
⇒原子の構造について図を使ってわかりやすく解説>
でも中性子数は数が変わることがありますから
同じ種類の原子でも重さが違うということがあり得るということです。
これを同位体といいます。
同位体は以前解説した同素体とは名前が似ていますがまったく違います。
⇒同素体とは?わかりやすく解説
同位体とは重さの異なる原子のことをいいます。
別の言い方をすると同位体は原子番号が同じだけど質量数が異なるもののことです。
原子番号が同じということは同じ元素です。
以下、さらに詳しく同位体について炭素を例にわかりやすく解説していきます。
Contents
同位体とは?塩素を例に解説
同じ原子番号の原子で、互いに質量数が違う原子のこと
です。
同位体にはどんなものがあるのでしょう?
いろんな原子に同位体は存在しますが、
塩素を例に解説していきたいと思います。
塩素は原子番号が17です。
なので、塩素の同位体はどちらも${}_{ 17 } Cl $、${}_{ 17 } Cl $です。
でも質量数は違います。塩素の場合、質量数が35と37の2つがあります。
よって${}^{ 35 }{}_{ 17 } Cl $、${}^{ 37 }{}_{ 17 } Cl $です。
お互い同位体です。
原子番号は17と同じでも、質量数が違いますからね。
結局、同位体というのは質量数が異なる、
つまり言い換えると中性子数が違うってことです。
この辺の計算の仕方は前回の記事で下の方が解説しています。
⇒原子の構造について図を使ってわかりやすく解説
${}^{ 35 }{}_{ 17 } Cl $の中性子は18になりますね。
35ー17=18ですからね。
${}^{ 37 }{}_{ 17 } Cl $の中性子は20ですね。
結局、質量数が異なるということは
中性子の個数が違うということです。
なぜなら陽子数が同じだからです。
原子番号は同じなので。
ここも前回の記事で解説しています。
⇒原子の構造について図を使ってわかりやすく解説
陽子数は同じだけど中性子数が異なってくるから
合計が変わってくるわけです。
同位体について炭素を例に解説
こちらの周期表をご覧ください。
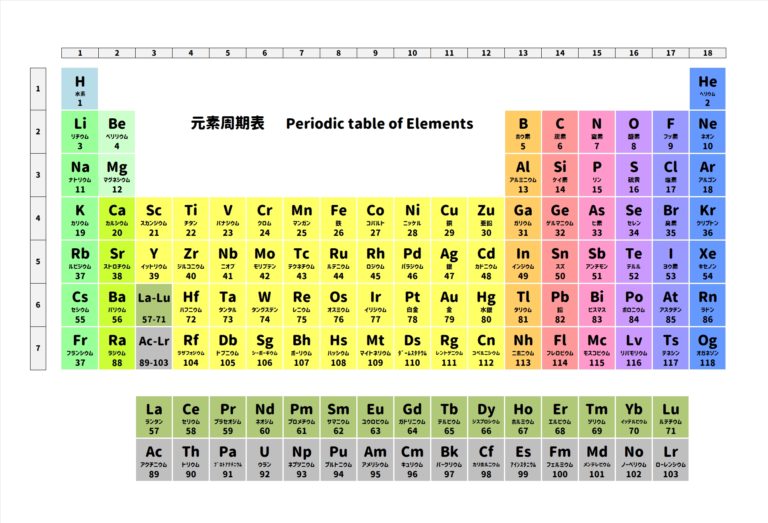
炭素原子は元素記号『C』と書きます。
炭素は何番目に出てきていますか?
炭素は周期表の6番目に出てきていますね。
だから原子番号は6になります。
周期表を見ると、
炭素Cの元素記号の下に『6』という数字が書いてますね。
この『6』という数字が原子番号です。

そんなことから上記のように元素記号の左下に原子番号を書きます。
原子番号は陽子の数と等しいんでしたね。
⇒同素体とは?わかりやすく解説
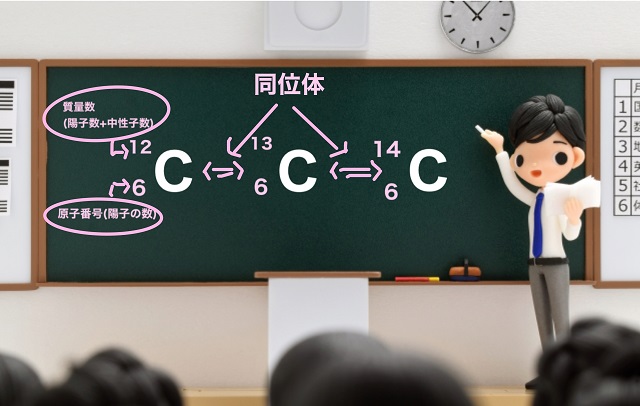
ところで左上の数字、質量数と、左下の数字、原子番号(陽子の数)の2つの数字から
原子核の中に含まれている中性子の数がいくつか?わかります。
質量数=陽子の数+中性子の数
原子番号=陽子の数
ですから、
質量数-原子番号=中性子の数
となりますね。
ということは、黒板の一番左の炭素の場合、
中性子の数は12―6=6個
同様に真ん中の炭素は13―6=7個
一番右の炭素は14-6=8個
となります。
こんな感じで中性子数がそれぞれ異なる同位体。
重さは違いますが、化学的な性質はまったく同じという特徴があります。
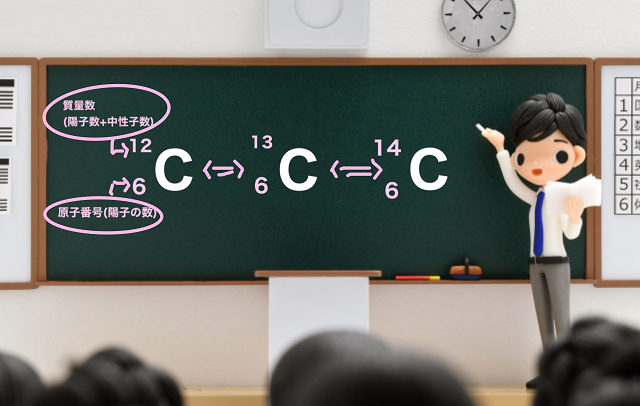
次に上記黒板内容をご覧ください。
炭素Cの左上に数字が書いてますね。
左上に数字が書いてあったら、その数字は質量数を意味しています。
質量数=陽子の数+中性子の数
でしたね。
中性子が7粒あれば
陽子の数と中性子の数を足したものが質量数。
質量数は元素記号の左隅上に書きます。
鉛筆の芯をガンガン細かくしていって炭素原子を調べます。
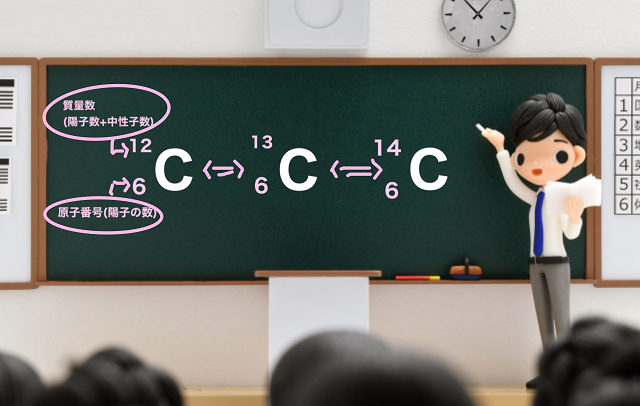
そうすると100個炭素原子を拾ってきたら
おおよそ1個は上記画像の真ん中の質量数が13の炭素です。
ところがおおそよ99個は質量数が12の炭素になります。
言い方を変えると質量数が12だから中性子の数は12から陽子の数を引いて6になります。
細かくした炭素原子を100万個くらい拾ってくると中性子の数が8(質量数が14)の炭素が見つかります。
このように同じ炭素なのに、同じ鉛筆の芯から出てくるくせに
中性子の数が違う、質量数が違う、これを同位体の関係にあるといいます。
で、上記黒板には炭素Cが3つありますが、
質量数が12、13、14とそれぞれ違いますね。
この関係性を同位体の関係といいます。
以前解説したのは『同素体(どうそたい)』でした。
同素体は『SCOP(スコップ)』と覚えましょう。
⇒同素体の覚え方|獣医師が受験時代に使った方法をご紹介!
今回のは『同位体(どういたい)』ですからね。
・陽子の数は同じ
・原子番号は同じ
・質量数は異なる
・中性子の数は異なる
ものです。
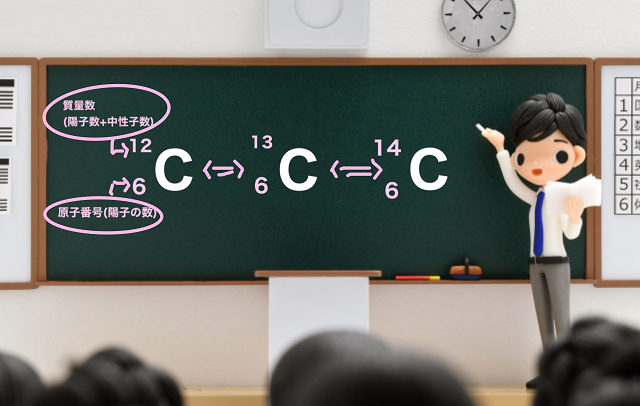
特に上の画像でも左の2つで質量数が12のものは中性子数は6で陽子数と同じ、
質量数が13のものは中性子数は7で陽子数より1個多いだけ。
質量数が12と13のものは中性子数と陽子数はほぼ同じなので原子核が安定なのです。
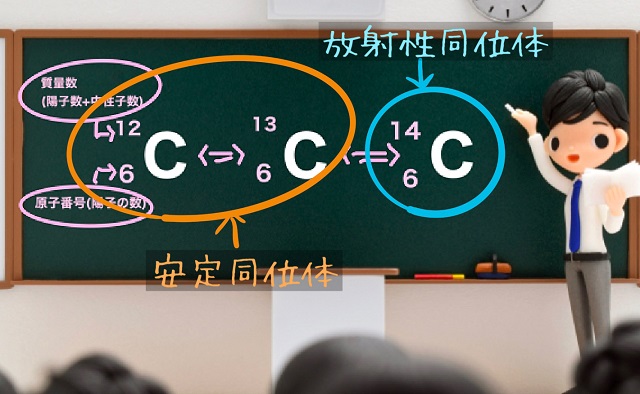
数万年経っても数十万年経ってもずっとこのままなので、
こういうのを安定同位体といいます。
ところが質量数が14の炭素がくせもので、
陽子6個に対して中性子が8個です。
中性子が多すぎます。
中性子が多すぎると原子核が不安定になります。
不安定なものって安定になろうとします。
そのときに何が起こるか?というと放射線を出します。
放射線というと聞いたことがある方もいるかもしれませんが
α線、β線、γ線などがあります。

こんな感じで不安定な原子核が安定な原子核に変わるときに
α線、β線、γ線などの放射線を出しながら
安定な原子核に変わっていく、こういうのを放射性同位体とかラジオアイソトープといいます。
この放射線をガンの治療やジャガイモの発芽を防止するために
利用したりします。
この放射線をガンの治療なんかにも使っているというようになっていると
獣医師国家試験や看護師国家試験を受けようとしている方にとっては
重要な知識になります。
⇒プロフィールと当ブログを作ることになったきっかけ
「なんか聞いたことがあるな」っていう背景があるので
頭に残りやすくなってきますからね。
やっぱり単純に放射線という記号で頭の中に入れてもピンとこないはず。
でも不安定な原子核が安定な原子核になるときに放射線を出すんだという話を
知っておくと頭に残りやすくなると思います。
きちんとわかったものは単純に試験に突破するだけではなくて
その後の仕事の中でも活きてきます。
だから単純に記号的に捉えるというよりは意味が分かったうえで
捉えていったほうが後になって役に立っていきます。
次の記事で詳しく解説することにします。
⇒放射性同位体の炭素の特徴と活用方法をわかりやすく解説

最後にただ単に同位体っていうこともありますが
放射線を出すとか出さないとかいう話になってきたら
安定同位体とか放射性同位体という形で区別してよびます。
放射性同位体は放射線を出しながら違う安定な原子核に変わるっていいました。
そのときに不安定なものが安定になるんだったら不安定なものは減っていきますよね。
この減り方に特徴があります。
この質量数14の炭素が減って行って半分になるまでの時間のことを半減期といいます。
半減期とは元の量の半分になるまでの時間のことをいいます。
今後、放射線を扱ったりするような仕事に就く人は半減期という用語を
使うことがでてきますが、半分になるまでの時間のことです。
以上で同位体についての解説を終わります。