今回の記事では白金電極で電気分解したときの反応式について
わかりやすく解説いきます。
ただ、今回の記事の内容は以下の記事が前提になっています。
ですので、もし読んでいて意味がわかりにくいと感じたら
以下の記事を読んでみてください。
白金電極で電気分解したときの反応式
例題を使って反応式を作って行きましょう。
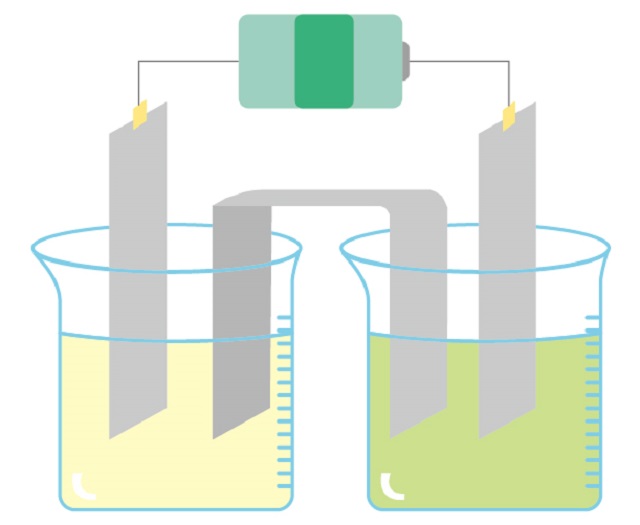
プラス極(陽極):白金(Pt)
マイナス極(陰極):白金(Pt)
の状況で硫酸銅を電気分解した時の反応式の作り方
と両方とも極板に白金(Pt)を使って
硫酸銅($CuSO_4 $)を電気分解したとしましょう。
陽極と陰極ではそれぞれどんな反応が起こるでしょう?
まず陽極から。
陽極の考え方はこちらの記事で詳しく解説しています。
⇒電気分解における陽極の反応の覚え方についてわかりやすく解説
陽極の極板は白金(Pt)です。
白金は電子を出さない安定した極板でしたね。
前回の記事でかなり詳しく解説しています。
なので硫酸銅($CuSO_4 $)から電子を取れないか?検討するわけです。
でも硫酸イオン($SO_4^{2ー} $)も安定しているので電子を出しません。
だから水酸化物イオン($OH^{ー} $)が電子を出すという流れになります。
この流れはくどいようですが以下の記事でかなり詳しく解説しています。
⇒電気分解における陽極の反応の覚え方についてわかりやすく解説
なので陽極では以下の反応式になります。
$4OH^{ー} $⇒$O_2 $+$2H_2O $+$4e^{ー} $
という形で陽極では酸素が発生するということを導くことができました。
次に陰極。
陰極はいちいち極板を見たり考えたりする必要がありませんでしたね。
陰極では水溶液の陽イオンを見ます。
陰極については以下の記事で詳しく解説しています。
⇒電気分解陰極の特徴・考え方についてわかりやすく解説
水溶液は硫酸銅($CuSO_4 $)で陽イオンは銅イオン($Cu^{2+} $)ですね。
銅は金属なのでそのまま析出しますね。
このことを反応式で表せばよいわけですから、
陰極の反応式は以下のようになります。
$Cu^{2+} $+$2e^{ー} $⇒$Cu $
です。
こんな感じで白金(Pt)が極板の場合には陰極からは銅が出て、
陽極からは酸素が発生するということです。
陽極:$4OH^{ー} $⇒$O_2 $+$2H_2O $+$4e^{ー} $
陰極:$Cu^{2+} $+$2e^{ー} $⇒$Cu $
となります。
陽極は炭素棒(C)陰極は鉄(Fe)で電気分解したときの反応式の作り方
次はおまけになります。
ただ極板が白金(Pt)の応用編なので意味があると思って記事にします。
陽極は炭素棒(C)で陰極は鉄(Fe)、
それから食塩水を電気分解した時の反応式を作ってみましょう。
陽極から考えましょう。
何を見ましょう?
極板ですね。
極板はC(炭素)なので安定していますから電子を出せません。
⇒電気分解における陽極の反応の覚え方についてわかりやすく解説
そして陰イオンは塩化物イオン($Cl^{ー} $)です。
塩化物イオン($Cl^{ー} $)は電子を出してくれます。
これも前回の記事の復習になります。
⇒電気分解における陽極の反応の覚え方についてわかりやすく解説
なので
$2Cl^{ー} $⇒$Cl_2 $+$2e^{ー} $
となります。
次に陰極の反応式を組み立てましょう。
陰極は極板を見る必要がありません。
食塩水の$Na^{+} $(ナトリウムイオン)はどうでしょう?
ナトリウムは水にも溶けますから
ナトリウムがもらうくらいなら水素がもらうということで
水素イオンが登場するんだと前回の記事で解説しました。
⇒電気分解陰極の特徴・考え方についてわかりやすく解説
よって
$2H^{+} $+$2e^{ー} $⇒$H_2 $
となります。
こんな感じで陰極では水素イオンが電子をもらって水素が発生します。
よってこの反応からは陽極からは塩素が発生し
陰極からは水素が発生するということを導くことができます。
以上で解説を終わります。