前回の記事ではボルタ電池などの電池について解説しました。
今回の記事では電気分解における
陽極の反応の覚え方についてわかりやすく解説していきます。
Contents
電気分解における陽極の反応の覚え方
電気分解は電池と比べるとちょうど反対です。
電池というのは電力を供給する側です。
これに対して電気分解はそのエネルギーをいただく側です。
そしていろんな物質を分解していきます。
なので前回解説した電池は電力を作る人、
今回解説する電気分解は食べる人という関係にあります。
⇒ボルタ電池の仕組みと欠点についてわかりやすく解説
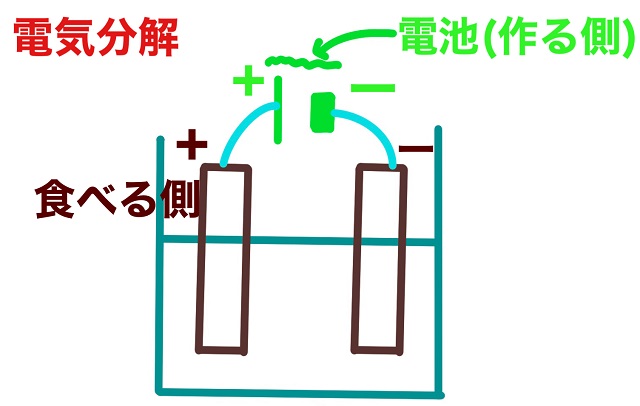
ところで電池の記号って知ってますか?
上記図でいうと左側の細長いほうがプラス(正極)で
右側の太くて短いほうがマイナス(負極)です。

ここで重要なお話をさせていただきます。
できたら正座して聞いて欲しい話です。
電気分解や電池でプラスとマイナスを取り違えたら
すべての話が逆になってしまいます。
せっかく勉強しても残念な結果になってしまいます。
だからプラスとマイナスを間違えないようにお願いします。

話を元に戻します。
食べる側(電池のプラスとつながっている側)も左側がプラスです。
なので作る側も食べる側もどちらも左側はプラスです。
普通は電池をたくさんおもちゃに入れたりしますよね。
このときプラスマイナスと交互になるように入れましたね。
ですが、今回の場合は別です。
作る人食べる人どちらも同じ側はプラスです。
ここは間違えやすいのでご注意ください。
それから電池のマイナスにつながっている方をマイナスと定義します。
・電池のプラスとつながっている方をプラス(陽極)
・電池のマイナスとつながっている方をマイナス(負極)
と定義します。
だからここは覚えるところではありません。
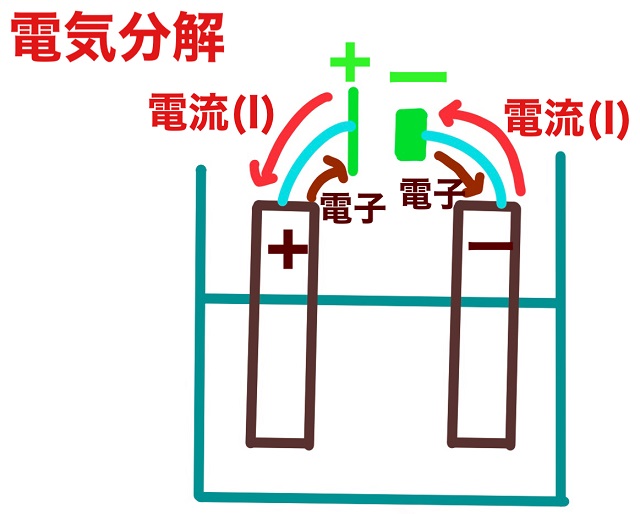
では電流の向きについて説明します。
電流は電池のプラスから出ます。
そして電流は電池のマイナスに入ります。
これは復習になります。
詳しくはこちらで解説しています。
⇒ボルタ電池の仕組みと欠点についてわかりやすく解説
それから電子は電流と逆向きです。
こういう理解によって電気分解で覚えるべき量を減らすことができます。
これは電池の知識でいけるところですからね。
・電流は電池のプラスから出て、電池のマイナスに戻る
・電子は電池のプラスに行き、電池のマイナスから出る
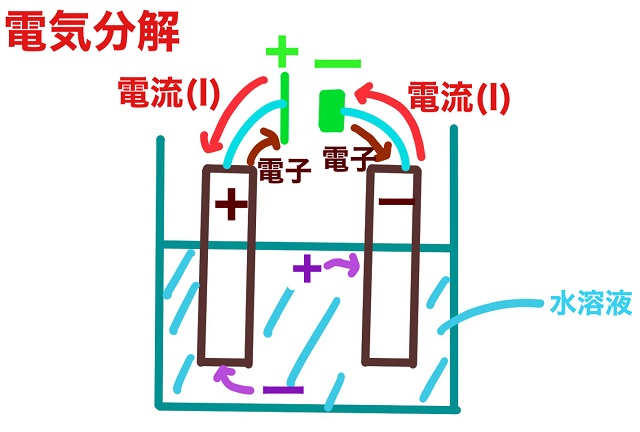
次に水溶液。
イオンが溶けています。
プラスの陽イオンとマイナスの陰イオンが溶けています。
これは自然に考えてください。
陽極(プラス極)にはマイナスのイオンがひかれていきます。
負極(マイナス極)にはプラスのイオンがひかれていきます。
ではここからが本題です。
電気分解|陽極は酸化反応?還元反応?

まず電池じゃないプラス極を何というのでしょう?
正極ですか?違いますね。作る側の電池はプラス極を正極といいます。
ですが食べる人の方はプラスは陽極といいます。
・作る人(電池)のプラスを正極
・食べる人(電気分解)のプラスを陽極
といって区別します。
では陽極では何が起きているのでしょう?
酸化反応が起こっています。
でもちょっとピンとこないかもしれませんね。
酸化反応とはどんな反応なのでしょう?

上記図をよく見てください。
陽極から電子が出て行っていますね。
酸化反応ってちょっといい加減な反応なので勘違いしやすいです。
たとえば
・酸化『される』
・還元『する』
という表現ができます。
どちらも間違っていません。
『する』と『される』をひっくり返すと
酸化と還元はひっくり返ってしまいます。
ですから大事なことは陽極の反応は酸化反応なのですが酸化『される』ということです。
酸化『する』ではありませんのでご注意ください。
陽極は電子が出ていく方ですからね。

陽極の反応で覚えるべきことは上記図です。
上記図を理解しておけばあとは勝手に答えを導き出すことができますから。
陽極では酸化反応=酸化されている
(電子が出て行っているから)
となります。
電気分解|陽極が銅板や銀板のケースで覚えるべきポイント
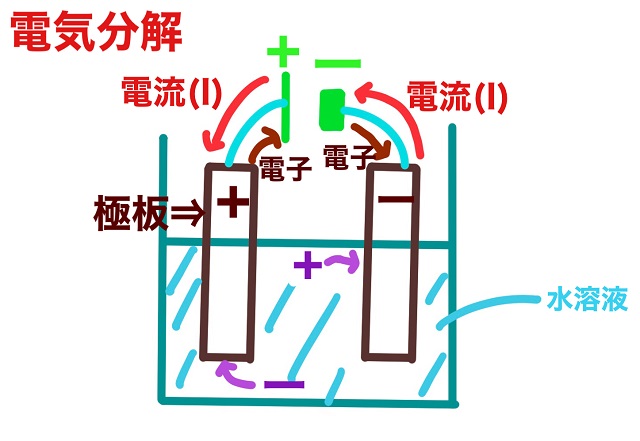
まず陽極の極板を見てください。
何が溶けているか?は後回しです。
極板は上記図で茶色の四角部分です。
陽極の極板がCu(銅)やAg(銀)板のときどうなるでしょう?
溶けます。暗記は不要です。
陽極は電子が出ていくわけです。
この電子は誰が負担するのでしょう?
電子を負担するスポンサーを特定するわけです。
極板が銅板や銀板の場合には極板がスポンサーになってくれます。
なので銅や銀の場合、半反応式で考えると右辺に電子($e^{ー} $)がきます。
$Cu $⇒$Cu^{2+} $+$2e^{ー} $
(右辺に電子があるということは電子が出ているということ)
となります。
結果として銅(Cu)は銅イオン($Cu^{2+} $)になります。
銅イオンになるということは結果として銅は溶けるということです。
これはイオン化傾向のところで解説しています。
イオン化傾向が高いということは溶けやすく錆びやすいんでしたね。
⇒イオン化傾向が大きいほど何がいえるか?
理屈抜きで覚えようとしないでくださいね。
極板が銀や銅の場合には銅板や銀板がスポンサーになってくれる。
つまり電子を出してくれる。
銅や銀はイオンになるから、結果として銅や銀は溶けるということ。
です。
なので陽極が銀や銅の場合はこの程度の知識で十分です。
電気分解|陽極が炭素(黒鉛)や白金(Pt)のケースで覚えるべきポイント
たとえば炭素棒。
ダイヤモンドでは電気を通さないので、
黒鉛を想像してください。
黒鉛が溶けて真っ黒けの状況って想像しにくいですよね。
他にも白金(Pt)。
白金はイオン化傾向がすごく小さいので安定しています。
⇒イオン化傾向が大きいほど何がいえるか?
なので白金と黒鉛は安定です。

安定は困ります。
なぜなら銅や銀みたいに電子を出してくれないからです。
言い方を変えると白金や黒鉛は電子を出してくれないのでケチなわけです。
白金や黒鉛からしてみると「私は電子なんて出しませんわよ!」
って言っているような感じです。
これが「安定」という意味です。
電気分解の場合、陽極からしてみると
誰かが電子を出してくれないと困ってしまいます。
そんなときに黒鉛や白金は電子を出してくれません。
ではどうしたらよいのでしょう?

上記図をご覧ください。
水溶液中のマイナスのイオンが陽極にひきつけられていますね。
このマイナスのイオン(陰イオン)を利用しない手はありません。
(1)まず極板を見る
⇒CuやAgは電子を出すからそれでOK
黒鉛や白金は電子を出さないから困る
(2)そこで黒鉛や白金は水溶液中のマイナスのイオン(陰イオン)を利用する
という2段階のステップで覚えておけばOKです。
こんな感じで極板が優先されます。
ただ陰イオンにもいろんなものがあります。
(1)陰イオンが塩化物イオンのとき
たとえば食塩水は塩化ナトリウム($NaCl $)とか塩化銅($CuCl_2 $)の場合ですね。
塩化物イオン($Cl^{ー} $)が入っています。
水に溶けたら電離してイオンになるんでしたね。
電離とは水に溶かすと
陽イオンと陰イオンに分かれてしまう現象のことです。
⇒電離度覚えるべきもの一覧と公式について解説
⇒電離定数を使ったpHや電離度の求め方をわかりやすく解説
話を元に戻します。
陰イオンが塩化物イオン($Cl^{ー} $)のときには塩素($Cl_2 $)が発生します。
$2Cl^{ー} $⇒$Cl_2 $+$2e^{ー} $
となります。
(2)陰イオンが硫酸銅水溶液あるいは硝酸銀水溶液のとき
$SO_4^{2ー} $(硫酸イオン)や$NO_3^{ー} $(硝酸イオン)のときどうなるでしょう?
これら2つは非常に安定しています。
特に$NO_3^{ー} $(硝酸イオン)は自分が欲しいくらいです。
酸化力のある酸といって銅を溶かしたりします。
とにかく$SO_4^{2ー} $(硫酸イオン)や$NO_3^{ー} $(硝酸イオン)は安定しています。
なので陽極に対して電子をあげようとしません。
こうなったらどうしたらよいでしょう?
そもそも極板が電子を出さないから
水溶液中の陰イオンに着目しているわけです。
その水溶液中の陰イオンも電子を与えないとなると
お手上げ状態といえますよね。
でも誰かが電子を出してくれないと電気が流れません。
そんなときに水酸化物イオン($OH^{ー} $)が助けてくれます。
$4OH^{ー} $⇒$O_2 $+$2H_2O $+$4e^{ー} $
と水酸化物イオンが助けてくれて電子($e^{ー} $)を出してくれます。
こんな感じで誰も電子を出さないという事態に陥った時には
水酸化物イオンが電子を出してくれるのです。
だからどんなに困っても最後は水酸化物イオンが電子を出してくれるので
最後は結果として酸素($O_2 $)が発生します。
酸素が出るのは結果論です。
このように覚えておきましょう。
こんな感じで必ず誰かが電子を出してくれます。
誰が電子を出すか?を特定するのが肝心な作業ということになります。
水酸化物イオンの謎
ただ疑問に感じた方はいませんか?
水酸化物イオン($OH^{ー} $)ってアルカリ性(塩基性)ですよね。
⇒酸塩基の見分け方についてわかりやすく解説
「酸性だったらどうするの?」って疑問がわきませんか?
結論として、水酸化物イオンはアルカリ性(塩基性)ですが
酸性であっても水はほんの少し電離します。
$H_2O $⇔$H^{+} $+$OH^{ー} $
となります。
以前の記事で水のイオン積について解説しました。
この記事を読んでいただければ理解できると思います。
⇒水のイオン積はなぜ一定に保たれるの?
どんなにアルカリ性でも水素イオンはいますし
どんなに酸性でも水酸化物イオンはいます。
なので酸性の溶液であっても必ず水酸化物イオンは存在します。
だから電子がなくて困っている状況であれば
水酸化物イオンが助けてくれるのです。
電気分解における陽極の反応の覚え方まとめ
大丈夫ですか?
陽極は電子を出すわけです。
そこで誰が電子を出すのか?
まず最初に(1)極板。ダメだったら(2)陰イオンという流れで特定していくという
大きな流れを覚えておけば簡単に暗記できると思います。
以上で解説を終わります。