今回の記事では
・原理
・例
・計算
・なぜpHが動かないか?
などについてわかりやすく解説していきます。
緩衝溶液
まず最初は言葉の意味から理解していきましょう。
この記事では『緩衝溶液』について解説していますからね。
最初は『緩衝溶液』という言葉のイメージを掴んでおいた方が
後が楽になりますよ。
高校化学だと緩衝溶液のことをバッファー(buffer)ということがあります。

緩衝溶液の『緩衝』とは衝撃を和らげるという意味です。
つまり緩衝溶液とはクッションのような溶液ということです。
では何がクッションなのでしょうか?
そこから理解していきましょう。
緩衝溶液はなぜpHが動かないの?原理とともに解説
緩衝溶液には以下のような特徴があります。
pHの変化が小さい
です。
緩衝溶液はあまりpHが変化しないという特徴があります。
たとえばHClみたいな強酸や
NaOHみたいな強塩基を加えるとpHが大きく動きますよね。
でも緩衝溶液はpHが動かないようにブロックできるという特徴があるのです。
別の言い方をすると緩衝溶液はpHが安定する溶液だってことです。
緩衝溶液さんの特徴はpHが安定ってことですかね
— にゅるまこ (@sikometuryusen) September 6, 2013
大学に入ると緩衝溶液を使った実験をすることがあるかもしれません。
⇒当ブログ管理人のプロフィール
特に酵素の実験をするときにはpHが
代謝産物で変化したら働きが失われてしまいやり直しになります。
講義時間中の実験であっても失敗したら大学によっては
夜遅くまでやり直しさせられるケースもあるのでご注意ください。
余談ですが私が通っていた獣医の大学では
外科実習でそういったことがありました。
手術の手袋をはめるまでなのですが、
ちょっとでも別のところに手が触れたら外科の教授が「again!」って言って
やり直しさせられるんです。
そして早朝から深夜まで帰れないみたいなことがありました。
今ではよい思い出です(苦笑)。
手術用の手袋の周囲に雑菌がついたら
犬や猫のお腹の中に雑菌が入ってしまい
腹膜炎を起こす可能性がありますからね。
それくらい大学の実習ってシビアだってことです。
話を元に戻します。
酵素系の実習ではpHが動いてしまってやり直しにならないために
緩衝溶液を入れてpHをしっかり固定してから開始するのが一般的です。
酵素系では緩衝溶液がないとpHが狂ってしまって実習になりません。
それくらい緩衝溶液って重要な溶液だってことです。
文化の日なので文化的に意義のあることをしてみた。
緩衝溶液。これなくして酵素を使う実験はできない。
・・・という割には,肝腎の緩衝能にほとんど触れていないという。本当に20年化学教えてるんですぅ💦
あぁしょっぺぇ。 pic.twitter.com/VR5YPPMCxo— ONゼミナール(公式)&長田俊将 (@ON43733181) November 3, 2022
ではなぜ緩衝溶液を使うとpHの変化が小さくなるのでしょう?
緩衝溶液はたくさん種類があります。
代表的な例は酢酸($CH_3COOH $)と酢酸ナトリウム($CH_3COONa $)です。
他にリン酸やTris(トリス)といった緩衝溶液などがあります。
ここでは酢酸($CH_3COOH $)と酢酸ナトリウム($CH_3COONa $)の混合溶液を
例に解説していきますね。
ちなみに「酢酸($CH_3COOH $)と酢酸ナトリウム($CH_3COONa $)の
2つが緩衝溶液として必要なの?」と疑問に感じる方もいるかもしれませんね。
でも絶対に2つとも必要です。
どちらか1つだけだったら緩衝溶液はできません。
必ず2種類が混ざっています。
2種類が混ざってないと緩衝溶液として働けません。
ところで酢酸ナトリウム($CH_3COONa $)はものすごく電離します。
だから酢酸ナトリウムは酢酸イオン($CH_3CO $$O^{ー} $)と
ナトリウムイオン($Na^{+} $)にみんな電離します。
それから酢酸($CH_3COOH $)はもともと弱酸でしたよね。
電離度が1%だと以前の記事で解説しました。
だからほとんど電離しません。
しかも酢酸ナトリウムは酢酸イオン($CH_3CO $$O^{ー} $)と
にみんな電離した状態で同じ溶液中に存在しますから
酢酸($CH_3COOH $)はますます電離しにくくなっています。
よって酢酸($CH_3COOH $)は電離せず大人しく$CH_3COOH $のままで存在しています。
なので酢酸($CH_3COOH $)と酢酸ナトリウム($CH_3COONa $)の混合溶液は
・$CH_3CO $$O^{ー} $
・$CH_3COOH $
の状態になって存在しているわけですね。
よろしいでしょうか?
たとえばここで塩酸HClを加えましょう。
塩酸は1価の強酸です。
つまり全部電離して$H^{+} $を出します。
だから同じ溶液中で
・$CH_3CO $$O^{ー} $
・$CH_3COOH $
・$H^{+} $
が存在することになります。
もしこれが緩衝溶液でないなら強酸のHClが入ったら
pHが思いっきり酸性側に傾きます。
でも緩衝溶液中に塩酸が入りました。
加わった$H^{+} $に対して$CH_3CO $$O^{ー} $が出動します。
ウイルスが体内で増えたら白血球がやってきてウイルスと戦うような感じです。
上記反応を式で表すと
$CH_3CO $$O^{ー} $+$H^{+} $⇒$CH_3COOH $
となります。
溶液中に入ってきた$H^{+} $を放っておいたらpHが一気に酸性側に傾きますから
$CH_3CO $$O^{ー} $がやってきて弱酸の$CH_3COOH $となります。
こうやって緩衝溶液というのはpHが変化しないような仕組みになっているわけですね。
逆にアルカリ性の溶液を加えたらどうなるでしょう?
たとえば水酸化ナトリウム(NaOH)を緩衝溶液に加えたらどうなるでしょう?
水酸化ナトリウム(NaOH)は1価の強塩基ですね。
強塩基ですから反応はみんな右側に移動します。
つまり、
NaOH⇒$Na^{+} $+$OH^{ー} $
ということで$OH^{ー} $が出ます。
塩基とアルカリの違いについてはこちらをご覧ください。
・アルカリと塩基の違いをわかりやすく解説
なので、$CH_3CO $$O^{ー} $ではなく、
$CH_3COOH $と$OH^{ー} $が反応します。
もし$OH^{ー} $と$CH_3COOH $が反応しなかったら
$OH^{ー} $が強塩基なので一気にpHがアルカリ側に傾きますね。
でも、しっかりと酢酸($CH_3COOH $)が反応してくれます。
結果、$OH^{ー} $が減ってくれるのでpHがあまり動かなくてすみますね。
式で書くと
$CH_3COOH $+$OH^{ー} $⇒$CH_3CO $$O^{ー} $+$H_2O $
となります。
こんな感じで酸($H^{+} $)を加えても
$CH_3CO $$O^{ー} $+$H^{+} $⇒$CH_3COOH $
となってpHはあまり動きませんし、
アルカリ($OH^{ー} $)を加えても
$CH_3COOH $+$OH^{ー} $⇒$CH_3CO $$O^{ー} $+$H_2O $
となってpHがあまり動きません。
以上が緩衝溶液によってpHがあまり動かない原理です。
だから緩衝溶液として$CH_3CO $$O^{ー} $と$CH_3COOH $の2種類が必要なのです。
もし酸($H^{+} $)を加えた時だけ
反応してpHをキープできたとしても
アルカリ($OH^{ー} $)を加えても反応しなくて
pHが上がってしまったら意味がありませんからね。
だから緩衝溶液は2種類入っているわけです。
酸を加えたら2種類のうちの1つが反応しpHをキープし、
アルカリを加えたら2種類のうちのもう1つが反応しpHをキープ。
こんな感じでどちらを加えても反応するのでpHがほとんど動かないのです。
以上が緩衝溶液の原理です。
緩衝溶液が関係する計算問題
【$CH_3COOH $】と【$CH_3COONa $】はともに0.1mol/L
とする。
このときのpHの値を求めなさい。
なお、
【$CH_3COOH $】は酢酸濃度、
【$CH_3COONa $】は酢酸ナトリウム濃度、
$log_{ 10 } 2 $=0.30、
$log_{ 10 } 3 $=0.48とする。
まず問題文から【$CH_3COOH $】と【$CH_3COONa $】はともに0.1mol/L
ということから、この溶液は緩衝溶液だとわかります。
それから電離定数は覚えていますか?
電離定数Kaは以下のようになりますね。
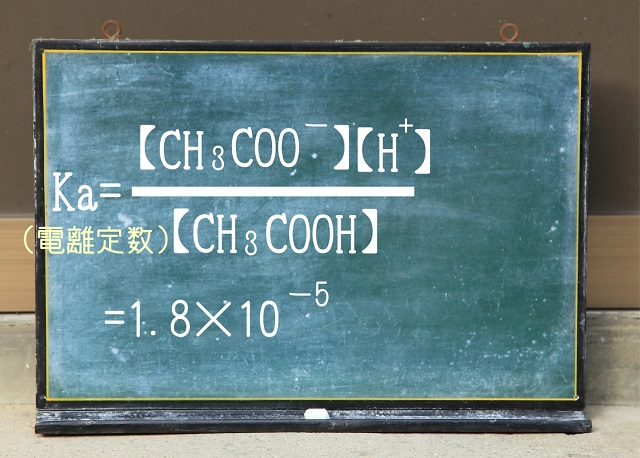
酢酸($CH_3COOH $)単独だけでなく
酢酸ナトリウム($CH_3COONa $)が混ざっていても
電離定数は一定だと以前の記事で解説しています。
つまりどんな溶液が混ざってきても
酢酸については必ず上記電離定数が成り立ちます。
問題文より酢酸濃度(【$CH_3COOH $】)=0.1mol/Lでした。
では酢酸イオン濃度(【$CH_3CO $$O^{ー} $】)はいくらでしょう?
酢酸イオン濃度(【$CH_3CO $$O^{ー} $】)は酢酸ナトリウム濃度(【$CH_3COONa $】)
のことですよね。
なので
【$CH_3COONa $】=【$CH_3CO $$O^{ー} $】=0.1mol/L
ということです。
意味がわからない方は
もう一度、この記事を読んでみてくださいね。
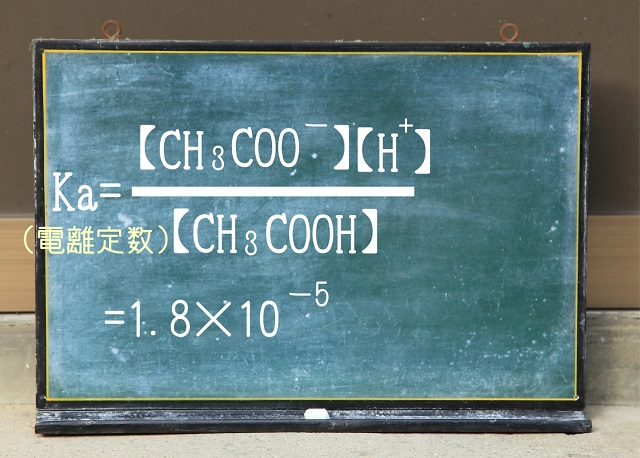
あと【$H^{+} $】が不明ですね。
よって
Ka=(0.1×【$H^{+} $】)/0.1
となりますね。
分子の0.1と分母の0.1は同じ数字だから消えますね。
分母と分子に0.1を掛け算すると考えてもOKです。
ということで
Ka=【$H^{+} $】
なので、【$H^{+} $】はKaと等しいです。
一番緩衝作用が強い代表的な緩衝液は1対1となって
分母と分子が消えてKa=【$H^{+} $】となってしまいます。
また
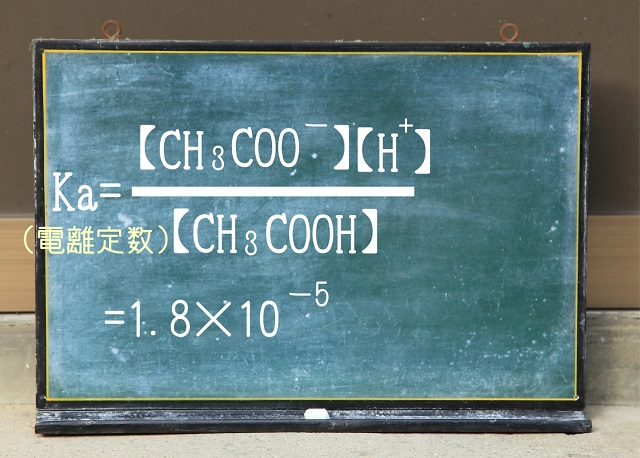
なので
Ka=【$H^{+} $】=1.8×$10^{-5} $=18×$10^{-6} $ですね。
pH=ー$log_{ 10 } [H+] $
でしたね。
pH=ー$log_{ 10 } [H+] $
で、底(てい)の10を省略して
pH=ー$log [H+] $と書きますね。
底がaの対数をlog(a)と書くと log(a)M=p⇔M=a^p 少し表記方法を変えてごめんね。これはよく使うから覚えておいて損はないよ。
— 理系吹雪bot (@rikei_fbk_bot) December 4, 2022
すると
pH=ー$log [H+] $
=ー$log $(18×$10^{-6} $)
=ー($log 18 $+$log $($10^{-6} $)
=ー($log $(3×3×2) ー6)
=ー2$log 3 $ー$log 2 $+6
問題文から$log_{ 10 } 2 $=0.30、
$log_{ 10 } 3 $=0.48なので、
pH=ー2$log 3 $ー$log 2 $+6
=-2×0.48-0.30+6
=4.74
よってpHは4.74
となります。
ここで大事なのは電離定数の使い方は2通りあるってことです。
1つ目は【$H^{+} $】=$\sqrt{CKa} $の場合、
もう1つは緩衝溶液の場合(今回解説しました)。
この2通りの計算方法を知っておきましょう。
緩衝溶液の例
緩衝溶液は酢酸と酢酸ナトリウムの組み合わせ以外にも
いろいろあります。
・$NH_3 $(アンモニア)と$NH_4Cl $(塩化アンモニウム)
です。
$NH_3 $(アンモニア)と$NH_4Cl $(塩化アンモニウム)
の組み合わせでも緩衝溶液ができます。
酢酸の裏返しと考えると理解しやすいかもしれません。
・弱酸の$CH_3COOH $(酢酸)を裏返すと弱塩基の$NH_3 $(アンモニア)
・強塩基のNaOH(水酸化ナトリウム)を裏返すと
強酸のHCl(塩酸)、つまり$NH_4Cl $(塩化アンモニウム)のこと
です。
そして$NH_4Cl $(塩化アンモニウム)はみんな電離して$NH_4^{+} $(アンモニウムイオン)になります。
そして酢酸のときと同様に$NH_3 $(アンモニア)もそのままで変化しません。
だから$NH_3 $(アンモニア)と$NH_4^{+} $(アンモニウムイオン)で考えることになります。
なので$NH_3 $(アンモニア)と$NH_4Cl $(塩化アンモニウム)の組み合わせは
$NH_3 $(アンモニア)と$NH_4^{+} $(アンモニウムイオン)の組み合わせは同じだということです。
酢酸の時と同様、
酸($H^{+} $)(たとえば塩酸を加えたケース)を加えたらアンモニア($NH_3 $)と反応するため
$NH_3 $+$H^{+} $⇒$NH_4^{+} $
となります。
$H^{+} $が入っても反応しなければ
pHが酸性側に傾いてしまうため、
緩衝溶液中の$NH_3 $と反応してpHが動かないような仕組みになっています。
そしてアルカリ($OH^{ー} $)を加えたら
緩衝溶液中の$NH_4^{+} $(アンモニウムイオン)が反応しますので
$NH_4^{+} $+$OH^{ー} $⇒$NH_3 $+$H_2O $
となってpHが動かないような仕組みになっています。
こんな感じで酸を加えても塩基を加えても
pHがほとんど変化しないという仕組みになっています。
他にも緩衝溶液の例はあります。
$NaH_2PO_4 $と$Na_2HPO_4 $でできた緩衝溶液があります。
この緩衝溶液は人間のpHである7.4付近にキープすることができます。
今日は人間のphが7.4ということを覚えました
語呂は「異常ナシ(7.4)」だとうです
( ᐛ )— 鮫島🦈 (@shark_k1202) December 4, 2022
人間だけでなく動物もだいたいpHは7.4前後(中性ということ)です。
人間や動物にとって酵素は重要でやはりpHは中性の物が多いです。
なので、酵素の実験なんかで
$NaH_2PO_4 $と$Na_2HPO_4 $でできた緩衝溶液を使います。
pHをほぼ中性付近でキープできるためです。
それから$NaH_2PO_4 $と$Na_2HPO_4 $でできた緩衝溶液の売、
どちらも全部電離してナトリウムイオンと分かれてしまうため、
$H_2PO_4^{ー} $と$HPO_4^{2ー} $となります。
$NaH_2PO_4 $と$Na_2HPO_4 $は$H_2PO_4^{ー} $と$HPO_4^{2ー} $と同じです。
ここで$H^{+} $(酸)を加えると
$HPO_4^{2ー} $と反応します。
$HPO_4^{2ー} $+$H^{+} $⇒$H_2PO_4^{ー} $
$OH^{ー} $(アルカリ)を加えると$H_2PO_4^{ー} $と反応します。
$H_2PO_4^{ー} $+$OH^{ー} $⇒$HPO_4^{2ー} $+$H_2O $
となり、酸、アルカリどちらを加えてもpHをキープすることができます。
以上で緩衝溶液についての解説を終わります。















