・半反応式
・起電力を高くする方法
について解説します。
Contents
ダニエル電池の反応式
まずこの記事では以下の記事の内容が前提になっています。
もし記事を読んでいて理解しにくいところが出てきたら
コチラをご覧ください。
⇒ボルタ電池の仕組みと欠点についてわかりやすく解説
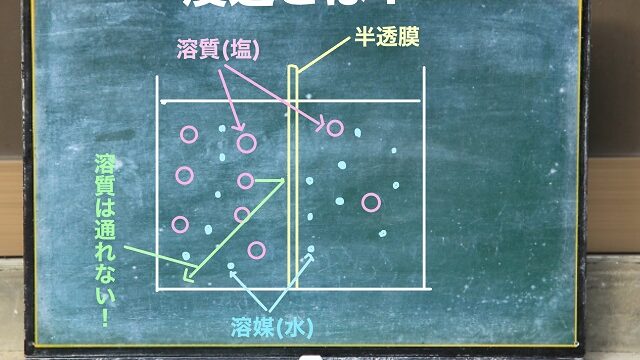
⇒濃淡電池の仕組みと反応式についてわかりやすく解説
ダニエル電池はダニエルというおじさんが作った電池です。
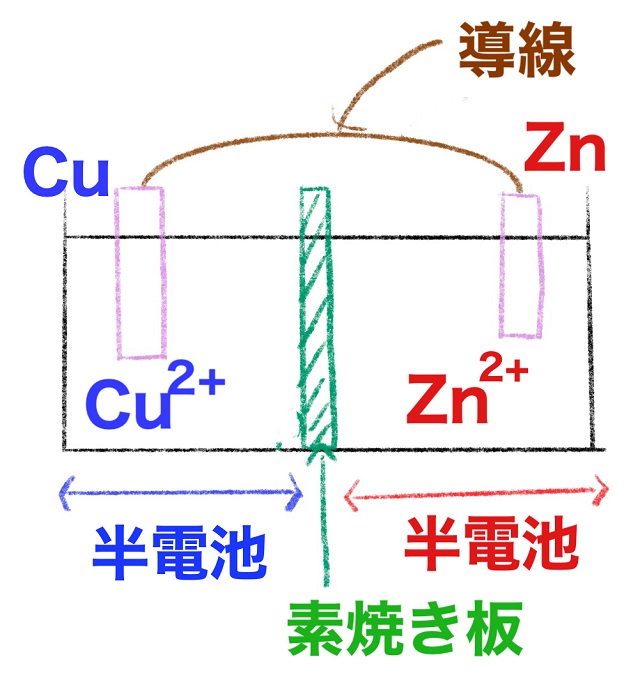
ダニエル電池はCu(銅板)とZn(亜鉛板)、
真ん中を素焼き板で仕切っておきます。
そしてCuの側には硫酸銅。
水に溶けているので$Cu^{2+} $(銅イオン)の状態になっています。
それからZnの側には硫酸亜鉛、
水に溶けているので$Zn^{2+} $(亜鉛イオン)があります。
水に溶けたらイオンになる理屈が分からない方は
電離(電離度)の記事をご覧ください。
⇒電離度覚えるべきもの一覧と公式について解説

話を元に戻しますね。
上記ダニエル電池の左半分を半電池といいます。
銅イオンに銅板という感じで
同じ種類の金属でできているものを半電池といいます。
濃淡電池で扱ったのは銀の半電池でした。
これは前回解説しています。
⇒濃淡電池の仕組みと反応式についてわかりやすく解説
それから右半分も半電池です。
亜鉛のイオンが溶けていて同じ亜鉛を挿したものですから
やはり亜鉛の半電池です。
半電池と半電池で1個の電池ができています。

まず以前解説したボルタ電池では何を発見しましたか?
⇒ボルタ電池の仕組みと欠点についてわかりやすく解説
イオン化傾向の小さいほうが正極(+)、
逆にイオン化傾向の大きいほうが負極(ー)になる
ということです。
次に前回解説した濃淡電池では
⇒濃淡電池の仕組みと反応式についてわかりやすく解説
濃度の高いほうが正極(+)になる。
逆に濃度の低いほうが負極(ー)になる。
ということでした。
以上のことを意識するとダニエル電池はすぐに理解できるようになります。
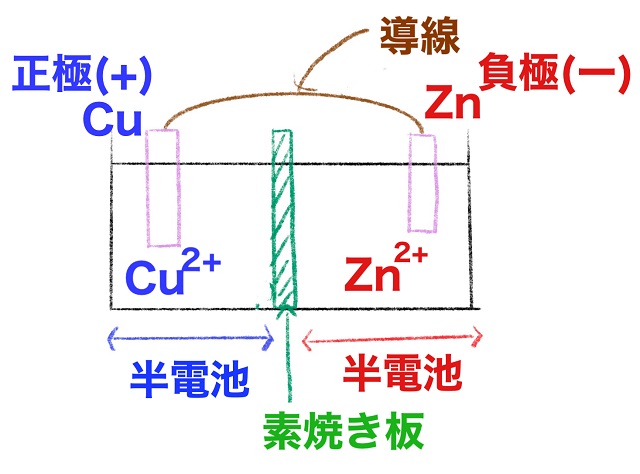
まずどちらが正極(+)でしょうか?
結論はCu板の方ですよね。
どうしてでしょう?
イオン化傾向が小さいほうが正極になるからです。
イオン化傾向についてはこちらの記事で詳しく解説しています。
⇒イオン化傾向が大きいほど何がいえるか?
実はイオン化傾向を利用した電池は必ず小さいほうが正極になります。
逆にイオン化傾向の大きなZnは負極(ー)になります。
反応式はZnの方がイオン化傾向が大きいのでイオンになります。
⇒イオン化傾向が大きいほど何がいえるか?
$Zn $⇒$Zn^{2+} $+$2e^{ー} $
となって電子を出します。
そしてCuの方はイオン化傾向がZnより小さい。
小さいということはイオンになりにくいです。
イオンになりにくいということはCuになってイオンから脱出しやすいです。
なので電子をもらいます。
なので
$Cu^{2+} $+$2e^{ー} $⇒$Cu $
となります。
ということでプラスとマイナスはスグに決められますし
何が起こっているかもすぐにわかります。
ダニエル電池の起電力を高くする方法
実は銅イオンと亜鉛イオンですが
濃さを調節することによって起電力が変わってきます。
濃度の高いほうが正極(+)になる。
逆に濃度の低いほうが負極(ー)になる。
を応用します。

では起電力を高くするにはどうしたらよいでしょう?
プラスの銅イオン、マイナスの亜鉛イオンを見ていきましょう。
濃度の高いほうが正極(+)になる。
逆に濃度の低いほうが負極(ー)になる。
から濃いほうがプラスになりますよね。
ということはプラスの銅イオン濃度の濃度を高くすればよいわけです。
間違いやすいのは亜鉛イオンも銅イオンもどちらも濃くすればいいという考えです。
これはダメです。
マイナスは逆に薄くしないといけません。
なぜなら濃度差によって起電力が生まれるからです。
これは濃淡電池のところで解説しています。
⇒濃淡電池の仕組みと反応式についてわかりやすく解説
負極(ー)はなるべく薄くすることが重要です。
正極の銅イオンの濃度を濃くする
負極の亜鉛イオンの濃度を薄くする
ということです。
これによって濃淡電池の起電力が加算され
より起電力が高くなるのです。
銅と亜鉛だけでもダニエル電池はできます。
これに加えてさらに濃度の差を利用することによって
濃淡電池の起電力も加算され、より起電力が高くなるということです。
濃度差がさらに追い打ちをかけます。
以上のことからボルタ電池と濃淡電池のポイントをしっかり理解したうえで
ダニエル電池について勉強すると
さらに化学の電池に関する理解が深まっていくということです。
⇒濃淡電池の仕組みと反応式についてわかりやすく解説
⇒ボルタ電池の仕組みと欠点についてわかりやすく解説
今回はダニエル電池について解説しました。