今回の記事では希薄溶液の性質の一種である、
凝固点降下について冷却曲線を使ってわかりやすく解説していきたいと思います。
凝固点降下でつまづいている人は多い
「凝固点降下がわからないよ!」って方は多いですね。
希薄溶液の沸点上昇 凝固点降下 分子量の計算 浸透圧 がわからないなぁ
— ももぁ(もいも) (@Prunus_persica0) April 4, 2022
凝固点降下とかいまいちわからない
_人人人人人人人_
突然の真面目投入
 ̄^Y^Y^Y^Y^Y^ ̄— 👼🏻ログアウト🍼 (@to_eh_i_xxx) July 27, 2015
冷却曲線を使って後でわかりやすく解説しますが
「過冷却と凝固点降下の違いがわからない」
という方もいますね。
過冷却と凝固点降下の違いがわからないオタク
— ㋑㋻㋛㋑™️ (@iwasie) June 18, 2016
今回解説する凝固点降下は希薄溶液の性質の1つです。
希薄溶液=薄い溶液のことです。
そもそもどうして希薄溶液に限定していると思いますか?
理由は簡単。濃くなるとズレてくるからです。
濃い溶液だと思ったような実験結果が得られないってことですね。
濃い溶液だと教科書に掲載されているような凝固点降下のグラフになりません。
だからあえて希薄溶液という縛りがあるわけですね。
これに対して今後解説する浸透圧は濃くても起こります。
ただ濃くなると計算にずれがでてきます。
この辺は知っておかないともし将来医療関係に進むのであれば
苦労する事が出てくるかもしれません。
⇒当ブログ管理人のプロフィール
それでは本題に入っていきましょう。
凝固点降下についてわかりやすく解説します
あなたは北極に行ったことがありますか?
私はありません。
北極海の海水の温度は0℃ではありません。
実はマイナス2℃くらいです。
これは凝固点降下が関係しています。
海水よりは温かいと思うけど海水も南極北極でも表面の氷結温度が-2℃程度だしなぁ 陸上の冬の方が寒いと思うけど……
— ことりとむ⛅ (@cotoryxxx) February 9, 2022
これはいろんなものが溶けているからです。
海であれば主に塩化ナトリウムが溶けています。
0℃になって水分子同士が寄ってきて凍ろうとするのですが・・・
間に食塩がいると0℃になっても水分子同士がくっつけません。
だからもう少し温度が低くならないと凍りません。
0℃になって凍ろうとしても塩化ナトリウムなどの邪魔者がいるから
凍れないのです。
だからもう少し低い温度でやっと凍るということです。
ここで凝固点降下の公式を出しますね。
Δt=K×C
Δt:凝固点降下度
K:モル凝固点降下(比例定数)
C:質量モル濃度
Δtが凝固点降下度です。
凝固点降下度は質量モル濃度に比例します。
質量モル濃度はこちらで解説しています。
・モル濃度の簡単な求め方についてわかりやすく解説
質量モル濃度が3倍だったら3倍下がります。
濃度が2倍だったら2倍下がります。
凝固点降下度という下がり具合というのは質量モル濃度に比例するということです。
たとえば、まったく溶けてなかったらΔt=Cとなります。
Δt=0となります。K(モル凝固点降下)は比例定数ですし、質量モル濃度が0ですからね。
ちなみにKは溶媒によって変わります。水のKは1.86です。
ただ、記事冒頭でもいいましたように希薄溶液という縛りがあります。
濃度が濃くなったらうまくいきません。
こんな感じで濃度が濃くなると凝固点が下がっていくということです。
このことを深く理解するために
次に冷却曲線について解説します。
凝固点降下とは?冷却曲線を使ってわかりやすく説明
水の凝固点は0℃です。
0℃で凍りますが、食塩水はもう少し低い温度で凍りますね。
では温度をゆっくり下げていきましょう。
温度をゆっくり下げていかないと、うまくいきませんからね。
以下のようなグラフになります。
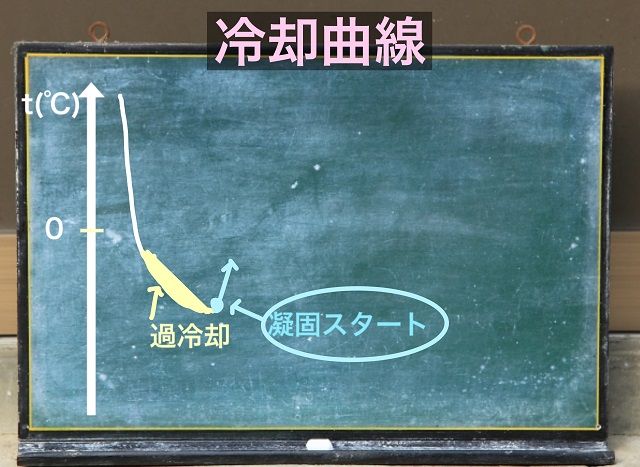
温度をゆっくり下げていくと凝固点よりも
温度が下がってしまいます。
これを過冷却といいます。
過冷却とは凝固点よりも一時的に低くなる現象のことです。
過冷却というのは一時的な現象。つまり不安定です。
凝固が始まると温度が上がります。
上記グラフはここまでのことを表しています。

凍っている時って水は0℃で一定なはずですね。
でも、食塩水など水に何かが混ざっている場合は
そんな単純な話にはなりません。
温度が下がっていきます。
なぜなら、初めのうちは水だけが氷るのです。
水分子同士がくっついて凍っていくわけですが
このとき、邪魔者の食塩を排除するのです。
ただ食塩が大量に入っている場合は排除しきれませんが。
薄い食塩水という前提だと・・・
最初の段階では水分子同士がくっついて氷を作るので
食塩は排除されます。
水だけが氷る
⇒食塩水は濃くなる
水だけが凍っていくので、液体の水の量は減るけど
食塩の量は変わりません。
よってどんどん食塩水の濃度は濃くなります。
どんどん濃度が濃くなるということは
凝固点降下はどんどん大きくなりますね。
質量モル濃度が上がるけど、Kは一定ですからね。
Δt=K×C
Δt:凝固点降下度
K:モル凝固点降下(比例定数)
C:質量モル濃度
凝固点降下が大きくなるので、
どんどん温度が下がっていくわけですね。

ここから上記グラフのように延長しましょう。
延長した交点を凝固点といいます。
過冷却というのは特殊な現象。
凝固点を低くしますが、あくまで液体です。
過冷却が起こらなければ凝固点から凍っていたはず。
だから、延長した交点を凝固点とするのです。
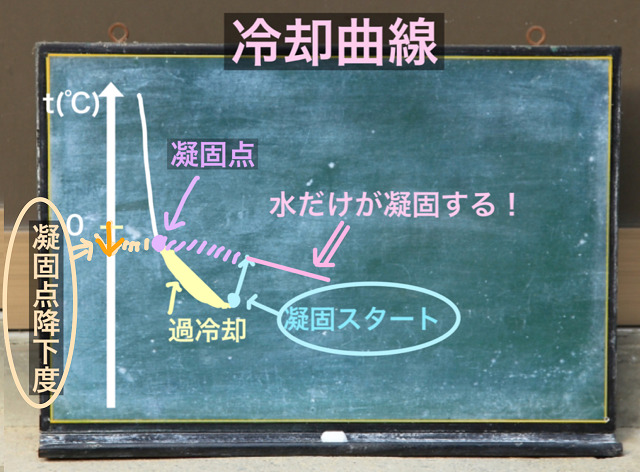
なので、0℃から凝固点まで下がったとなるので、
上記画像の0℃から下がった⇒部分が凝固点降下度となります。
矢印の幅があるからΔtとΔを使っているわけですね。
大丈夫でしょうか?
以上で凝固点降下についての解説を終わります。















