溶解って用語は中学校の理科でいきなり登場します。
なので、うちの中学生の息子は面食らってました(苦笑)。
ただ、溶解って水の中に粉を入れたら
キレイに混ざっている姿を日々目にしているので
現象自体は知っているでしょう。
溶解とは溶質が溶媒に溶けることをいいます。
たとえば塩(溶質)が水(溶媒)に溶けるのも溶解の一種です。
溶質とか溶媒とは何か?についてはこちらの記事で詳しく解説しています。
⇒溶媒・溶質・溶液の違いをわかりやすく例を挙げて解説
ちなみに融解と溶解は全く違いますからね。
・融解とは固体が液体に状態変化すること
・溶解とは溶質が溶媒に溶けること
をいいます。
「状態変化って何?」という場合にはこちらの記事をご覧ください。
⇒状態変化とは?図を使ってわかりやすく解説
⇒状態変化グラフの見方・考え方をわかりやすく解説
ではいったいどういうことが起きて溶解が起きているのでしょうか?
溶解が起きているプロセスを理解することで
しっかりと理解できるようになると思います。
溶解とは?図を使いながらわかりやすく解説
溶解のプロセスを理解することで溶解とはどんなものかが
よくわかると思います。
そこで$NaCl $(塩化ナトリウム、塩)を$H_2O $(水)に溶かす例をもとに
解説していきますね。
食塩水を作るとき、水に塩を入れてグルグルかき混ぜますよね。
すると最後は均一な水溶液に変化しますね。
このとき、どんな現象が起こっていると思いますか?
まず$NaCl $(塩化ナトリウム)の固体って
いったいどんなものでしょう?
こちらの図をご覧ください。

塩化ナトリウムの固体は陽イオンである$Na^{+} $(ナトリウムイオン)と
陰イオンである$Cl^{ー} $(塩化物イオン)がたくさん集まったものです。
プラスとマイナスの間には引き合う力が働きます。これをクーロン力といいます。
このクーロン力をもとにたくさんの陽イオンと陰イオンが集まってできた巨大な集合体が
塩化ナトリウムの固体です。
これはイオン結晶です。
⇒イオン結晶の特徴をわかりやすく解説
上記塩化ナトリウムの固体を水に入れます。
するとどうなるでしょう?
以下の図の右側をご覧ください。

塩化ナトリウムの固体を水の中に入れるとバラバラになります。
電離といいます。
電離とは水に溶かすと陽イオンと陰イオンに分かれることをいいます。
前回の記事でいうところの電解質は電離します。
⇒電解質と非電解質の違いと例
なので、陽イオンである$Na^{+} $(ナトリウムイオン)と
陰イオンである$Cl^{ー} $(塩化物イオン)にバラバラに電離していくわけですね。
と書くと、「やったー、$Na^{+} $と$Cl^{ー} $に電離したからこれで溶解ってことですね!
なーんだ、溶解とはで検索したけど、記事の冒頭だけ読めばよかったじゃん(苦笑)」
みたいに思った方いませんか?
でも、ちょっと待ってください。
電離した状態=溶解した状態ではありません。
まだ溶解の状態に達していないのです。
イオンがバラバラになった。
でも、まだ水に溶けた(溶解した)とはいえません。
このあと、水に溶けた状態(溶解した状態)になるためには
以下の図の一番右側の状態になる必要があります。
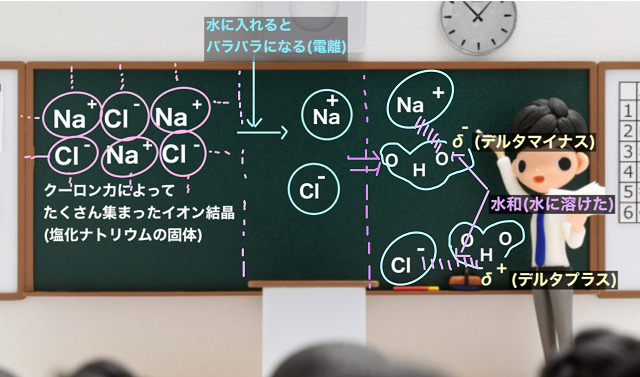
水に溶けるためには(溶解するためには)、水分子(H-O-H)が
電気的な力で$Na^{+} $(ナトリウムイオン)と$Cl^{ー} $(塩化物イオン)の周りを
取り囲まないといけないのです。
水分子(H-O-H)って酸素(O)がちょっとだけマイナスの電荷を持っています。
ちょっとだけマイナスのことをδ-(デルタマイナスと読む)といいます。
逆に水素(H)はちょっとだけプラスの電荷を持っています。
これをδ+(デルタプラス)といいます。
δは『少し』という意味です。
酸素(O)がマイナスに帯電(δ-)しているので
電気的な力でプラスの陽イオンによって行くのです。
逆に水素(H)はプラスに帯電(δ+)しているので
電気的な引力で陰イオンによって行きます。
こんな感じで水分子が電気的な力で周りを取り囲むことによって
始めて水に溶けた状態(溶解した状態)だと言えるのです。
このように電気的な力で周りを取り囲む現象のことを『水和(すいわ)』といいます。
水和した状態ではじめて水に溶けた(溶解した)と言えるのです。
『水和した状態=溶解した状態(溶媒に溶けた状態)』だといえます。
ですから電気的な力で水分子に周りを取り囲んでもらわないと
水に溶解したとはいえません。
では水に溶けやすいものってどんなものでしょう?
水に溶けやすいものはイオン($Na^{+} $や$Cl^{ー} $)とか
あとは電荷を持った粒子です。
電気を持ってたら電気的な力で取り囲みやすいですからね。
以上が溶解するまでのプロセスです。
ところで水和は水分子が周りを囲むから水和といいます。
もし他の溶媒も全部含めたら溶媒和(ようばいわ)といいます。
水以外にも溶媒はありますから。
水だったら水和ですけど、他の有機溶媒だったら溶媒和といいます。
溶媒分子が周りを取り囲むことによってはじめて溶解した状態が得られます。
水の場合は電気的な力で取り囲みます。
その他の有機溶媒はいろんな相互作用がありますが、
それによって周りを取り囲んで溶解した状態を作るのです。
こんな感じで溶解は2段階で起こります。
一度、バラバラにしてその後水和して水に溶けた状態になるのです。
こんな感じでイオン結晶は電離しないと水和は起こりません。
バラバラになって水和して初めて溶けた状態になります。
でも非電解質の場合、バラバラになれません。
イオン化しませんから。
そんな場合にはいきなり水和して溶解した状態になれます。
たとえばエタノールは非電解質ですから、
イオン化しないので、いきなり水和した状態になって水に溶解します。
他にもグルコースも非電解質なので
水に簡単に溶けます。
⇒電解質と非電解質の違いと例
以上で溶解についての解説を終わります。















