・電解質
・非電解質
の違いを例を挙げながら解説していく解説コーナーになっています。
電解質と非電解質は中学校3年生の理科で習いますが、
大学受験でも普通に出題される重要テーマの一つです。

この記事を書いている私は獣医師ですが、
獣医師国家試験でも電解質と非電解質についての知識が問われる
問題が出題されることがあります。
それくらい電解質と非電解質って重要な内容にります。
・電解質とは何か?
・非電解質とは何か?
・電解質と非電解質の違い
・電解質と非電解質の例
についてわかりやすく解説していきたいと思います。
Contents
電解質と非電解質の違い
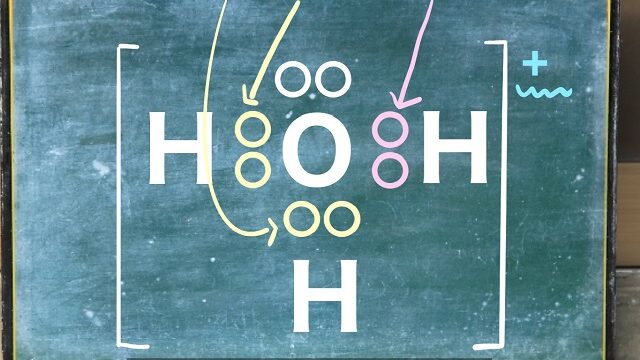
まず水に溶けた時、イオンに分かれる物質を電解質といいます。
陽イオンと陰イオンに電離できるものを電解質といいます。
ちなみに「電離って何?」
と疑問に感じた方もいると思うので解説します。
$Na_Cl $(塩化ナトリウム、塩)ってありますね。
$Na_Cl $は$Na^{+} $(陽イオン)と$Cl^{ー} $(陰イオン)の組み合わせで
できている物質です。
こういった陽イオンと陰イオンの組み合わせでできている物質って
水に溶かすと陽イオンと陰イオンに分かれてしまうのです!
この現象のことを電離といいます。
つまり、電離する物質=電解質って理解でもOKでしょう。
逆に水に溶けてもイオンに分かれない物質を非電解質といいます。
電離してイオンに分かれるか分かれないかの違いが電解質か非電解質かの違いになります。
ですから、電離しないで水に溶ける物質が非電解質となります。
では電解質ってどんなものなのでしょう?
電解質の典型例はイオン結晶です。
⇒イオン結晶の特徴をわかりやすく解説
陽イオンと陰イオンからなる固体(イオン結晶)が電解質の代表例です。
あとは酸とアルカリです。
⇒酸とは何?わかりやすく解説
⇒アルカリとは何か?種類とともわかりやく解説
ここまでまとめると
・イオン結晶($Na_Cl $(塩化ナトリウム、塩))
・酸とアルカリ(酸の例として塩酸、アルカリの例として水酸化カリウム)
です。
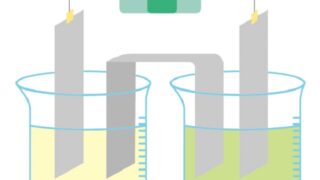
電解質の場合、水溶液は電気を通すという特徴もあります。
電解質の水溶液は電気を通すという特徴があるのです。
逆に非電解質は後で解説しますが、水溶液は電気を通しません。
これも電解質と非電解質の違いになります。
イオン結晶を溶かしたものであったり、
あるいは酸やアルカリを溶かしたものの水溶液は電解質であり、
電気を通す性質があります。
非電解質の具体例
電離しないで水に溶ける物質が非電解質となります。
非電解質の具体例としては『~ose』と名のつく物質となります。
読み方は『~オース』と読む物質は非電解質です。
この『~オース』と名のつく物質は糖類の仲間ですが、
グルコース(グルクオースみたいに読むと~オース)とか、
フルクトースとかガラクトースみたいに語尾が『~オース』となるものが非電解質の具体例になります。
電離しないものです。
他にも『~ol(~オール)』と読む物質も非電解質の具体例になります。
たとえば、エタノール、メタノール、プロパノール、エチレングリコールみたいに
語尾が『~オール』と読む物質も非電解質です。
この語尾が『~オール』と読む物質はアルコール類に分類されます。
あと有名な物は尿素ですね。
尿素はホルムアルデヒドとくっついてできる尿素樹脂が有名ですが、
尿素(オシッコの素みたいな感じ)という名前から
尿素樹脂はユリア樹脂という名前で利用されることもありますね。
尿素樹脂は私たちの日常生活で欠かせない商品に利用されています。
詳しくはこちらで解説しているので興味のある方はご覧ください。
⇒合成樹脂の具体例を3つご紹介します!
話を元に戻しますね。
尿素は以下のような構造式を持った化合物となります。
⇒化合物と混合物の違いをわかりやすく解説

尿素というのは水に溶かしても特に陽イオンと陰イオンに分かれて溶けません。
尿素のまま溶けています。
だから尿素は非電解質に分類されます。
ここまでまとめると
・語尾が~ose(~オース)・・・グルコースなどの糖類
・語尾が~ol(~オール)・・・エタノールなどのアルコール類
・尿素
です。
この非電解質が水に溶けた時、
水溶液は電気を導きません。
つまり、非電解質の場合、水溶液は電気を通しません。
陽イオンと陰イオンにイオン化しないものというのは
電気伝導性がありません。
電荷をもたない水溶液になるので電気伝導性がないのです。
非電解質というのは、陽イオンと陰イオンを作るわけではありません。
水溶液中にプラスやマイナスの粒がバラバラに散らばるわけではありません。
だから電気伝導性は出てこないのです。
この辺も電解質と非電解質の違いになります。
電解質だったら電気を通しますからね。
以上で解説を終わります。