今回の記事では熱化学方程式の頻出分野である
結合エネルギーの求め方についてわかりやすく解説します。
結合エネルギーの求め方
問題を使って結合エネルギーの求め方について解説していきますね。
$HCl $は塩化水素ですね。
「$HCl $は塩酸じゃないの?」って思った方もいるかもしれませんね。
塩酸でも問題ありませんが、
塩酸は塩化水素の水溶液です。
今回の$HCl $は水溶液に限られません。
なので、正確には$HCl $は塩化水素と読んでくださいね。
今回は$HCl $の生成熱は93KJ/molとします。
熱量は1molあたりで表現します。
$HCl $が1molできるときと10molできるときでは
当然熱量は10倍違います。
なので93KJ/molと『/mol』がつきます。
それから93KJ/mol
$HCl $の生成熱は93KJ/molとします。
$HーH $の結合エネルギーは434KJ/molとします。
$HーCl $の結合エネルギーは431KJ/molとします。
以上を前提にして
$Cl-Cl $の結合エネルギーを求めてください。
こんな感じで結合エネルギーも『KJ/mol』という単位を使います。
つまり結合エネルギーも熱量の単位を使うということです。
考えてみて欲しいのですが、
熱はエネルギーです。
だから熱量もエネルギーも同じ『KJ/mol』という単位を使います。
熱だって一種のエネルギーですからね。
以前の記事で熱化学方程式の基本的な考え方解き方は
かなり詳しく解説しています。
記事はこちらの記事を前提に書いています。
・燃焼熱と生成熱の違いを熱化学方程式を使いながらわかりやすく解説
・熱化学方程式を裏技で圧倒的に簡単に解く方法をコッソリ紹介!
・熱化学方程式を加減法で解く方法(解き方)
もう一度問題を見てください。
$HCl $の生成熱は93KJ/molとします。
$HーH $の結合エネルギーは434KJ/molとします。
$HーCl $の結合エネルギーは431KJ/molとします。
以上を前提にして
$Cl-Cl $の結合エネルギーを求めてください。
$HCl $の生成熱は簡単ですよね!?
忘れた方はこちらをご覧ください。
⇒燃焼熱と生成熱の違いを熱化学方程式を使いながらわかりやすく解説
$HCl $の生成熱を熱化学方程式で書きましょう。
$H_2 $+$Cl_2 $=$2HCl $+186KJ
生成熱から単体から作るんでしたね。
だから$H_2 $(水素)と$Cl_2 $(塩素)からできています。
当然ですが、$H_2 $(水素)の単体は水素ガス、$Cl_2 $(塩素)の単体は塩素ガスですね。
$H_2 $+$Cl_2 $=$2HCl $+186KJ
あと、熱量が186KJとなってますね。
問題文では93KJ/molとなってましたね。
これはできた2$HCl $と2molになっているからです。
つまり、93KJ/mol×2mol=186kJです。
熱化学方程式における熱量は物質1モルあたりで考えますからね。
2モル生成するわけですから、2×93=186KJです。
ところで結合エネルギーの求め方を理解するために
すごく重要な考え方があります。
それは何か?というと
バラバラほどエネルギーが高い
ということです。
たとえば液体よりも気体の方がエネルギーが高いです。
液体というのは分子間の距離が短いです。
気体は距離が離れています。
だから気体はいろんなところに移動できるわけですね。
気体は氷みたいに固まってませんよね。
液体はギッシリですが、気体はバラバラです。
つまり、引き離せば引き離すほどエネルギーは上がっていきます。
だから液体よりも気体の方がエネルギーは高いです。
同様に分子でいるよりもちぎってバラバラにして原子にした方がエネルギーが高いです。
こんな感じでバラバラにした方がエネルギーが高くなります。
これは大原則なので覚えておきましょう。
以上を前提にしてエネルギー図を書いてみますね。
エネルギー図の描き方を忘れた方はこちらをご覧ください。
・熱化学方程式とエネルギー図で発熱と吸熱反応を表すコツ
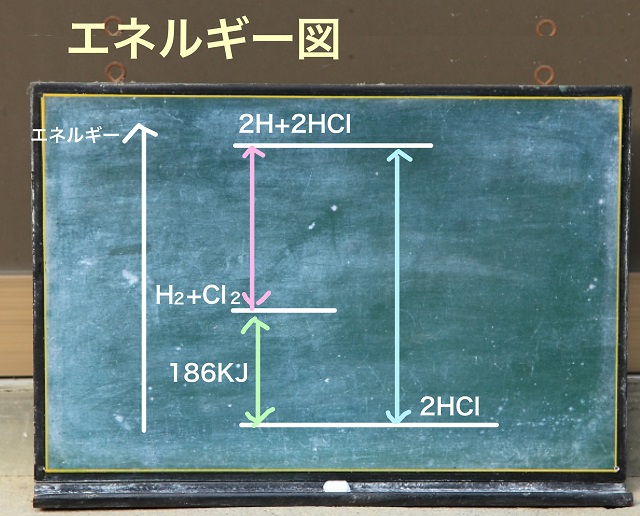
エネルギー図は上に行くほど高く、下に行くほど低くなります。
まずエネルギー図に
を書き加えましょう。
上記図の下の方をご覧ください。
$H_2 $+$Cl_2 $の方が高く、$2HCl $の方が低くなっていますね。
高低の差が186KJとなります。
右辺の$2HCl $に186KJを足すと
左辺の$H_2 $+$Cl_2 $とイコールになるという意味です。
つまり、右辺の方がエネルギーが低いということですね。
これが発熱反応です。
発熱反応を忘れた方はこちらをご覧ください。
・発熱反応で温度が上昇する理由とは?

そしてバラバラの方がエネルギーが高いわけですから、
完全にバラバラになった原子である$2H $+$2Cl $は
エネルギーが一番高い位置にきます。
上記エネルギー図から赤矢印と緑矢印を足すと
青色の矢印になるということがわかりますね。
ところで問題文より、
$HーH $の結合エネルギーは434KJ/mol
$HーCl $の結合エネルギーは431KJ/mol
でしたね。
$HーH $は$H_2 $(水素)のことで
水素原子Hと水素原子Hが共有結合してできています。
共有結合について忘れた方はこちらをご覧ください。
・共有結合とは?簡単に例を挙げながら解説します
結合を表すために試験問題では$HーH $と表現されることがあります。
結合エネルギーの問題では『結合』を表現するために$HーH $と記載されることがあります。
ご注意ください。
結合エネルギーは結合の強さと考えてもよいのですが、
さっきもいったようにバラバラの方が高くなりますよね。
結合エネルギーというのは結合を切るために
必要なエネルギーのことです。
ということは$HーH $の場合、434KJ加えると
1モルの$H_2 $(水素)の結合を切ることができるということです。
同様に$HーCl $は431KJ加えると$HCl $の結合を切ることができるわけですね。
問題になっているのは
$Cl-Cl $の結合エネルギーはいくらか?
でしたね。
もちろん$Cl-Cl $は$Cl_2 $(塩素)のことですよ。
$Cl_2 $(塩素)にいくら加えると結合を切ることができるか?
ということですね。
結合エネルギーとは結合を切るのに必要なエネルギーのこと
です。
ということで式を立てていきましょう。

まず$H_2 $(水素)を切るために問題文から
434KJ必要ですよね。
問題文やエネルギー図より$H_2 $(水素)は1モルなので
434KJのままでOKです。
それから$Cl_2 $(塩素)はわかりませんね。
これから求めるわけですからね。
だから$Cl_2 $(塩素)の結合エネルギーをXとおきましょう。
すると式は
434+X
となります。

434+Xのエネルギーを加えることで赤矢印を切ることができるわけです。
水素を切るために434で塩素を切るためにXのエネルギーを加えるわけですからね。
そして緑色のエネルギー186KJを足しましょう。
434+X+186
となります。
エネルギー図より
以上の式と青色のエネルギーと等しいですね。
青色矢印は$2HCl $塩化水素の結合を切るエネルギーですね。
塩化水素の結合エネルギーは431KJでしたね。
係数は2(2モル)なので2倍しましょう。
よって431×2=862KJとなります。
だから
434+X+186=431×2
という式ができます。
上記式を計算すると
X=242KJとなりますね。
答えは242KJ/mol
となります。
ちゃんと1モル(/mol)当たりで答えてくださいね。
1モルあたりと10モルあたりでは熱量が10倍違ってきますからね。
以上で解説を終わります。