アルカリ金属が水と反応しやすいのはなぜなのか、
今回の記事ではナトリウムを例にわかりやすく解説していきます。
アルカリ金属が水と反応しやすいのはなぜ?
イオン化傾向がものすごく大きいものに
カリウム、カルシウム、ナトリウムがありますね。
たとえばナトリウムはイオン化傾向が非常に大きくて
水に溶けて水素を発生します。
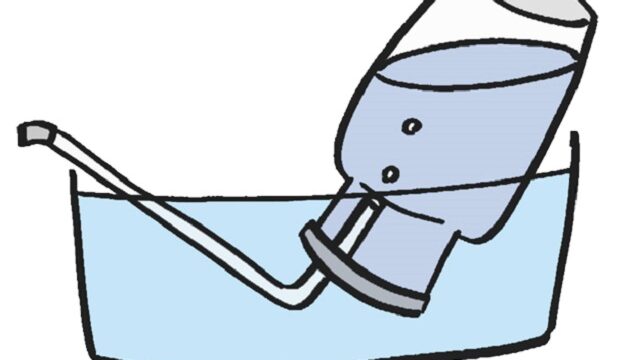
【Naと水の反応】
金属ナトリウムを水に濡らしたろ紙の上に落とすと黄色の炎を上げながら激しく反応するよ!発生した水素に引火し、軽い爆発も…
2Na+2H2O→2NaOH+H2
NaOHより、フェノールフタレインを入れると赤く!pic.twitter.com/mRn9y7kNhP— 実験たん (@Experiment_tan) March 9, 2023
水はほんのちょっとだけですが電離します。
$H_2O $⇔$H^{+} $+$OH^{ー} $
電離とは何か?気になる方はこちら
⇒電離度覚えるべきもの一覧と公式について解説
水のイオン積って覚えてますか?
⇒水のイオン積はなぜ一定に保たれるの?
とにかく水分子というのはほんの少しだけ電離します。
これは必ずです。
だから水は不死身だっていう方もいます。
そんな水に対してイオン化傾向がすごく大きいもの、
たとえばNa(ナトリウム)を加えたとしましょう。
$H_2O $(水)は中性です。
でも以下のようにほんのちょっとだけ電離していて
ほんのちょっとだけ$H^{+} $が存在します。
$H_2O $⇔$H^{+} $+$OH^{ー} $
イオン化傾向はNa>H
とナトリウムの方が水素より大きいですよね。
水に加えられたナトリウムは水素イオンを見逃しません。
水の中に水素イオンはほとんどありません。
でもナトリウムはものすごくイオン化傾向が大きいために
ちょっとしか存在しない水素イオンを見逃さないのです。
つまり、すかさずイオンになりやすいのです。
$2Na $+$2H^{+} $⇒$2Na^{+} $+$H_2 $↑
結果、水素はガスになり出ていくことになるのです。
もちろん、本当は電子を受け渡ししています。
ナトリウムは電子を失い、水素イオンはもらっています。
この辺はこちらの記事で詳しく解説しています。
⇒イオン化傾向が大きいほど何がいえるか?
それから$2OH^{ー} $を両辺に加えましょう。
$2Na $+$2H^{+} $⇒$2Na^{+} $+$H_2 $↑
における$2H^{+} $(水素イオン)は本当は水です。
だから当然$2OH^{ー} $をぶつけて水にしないといけません。
なので
$2Na $+$2H_2O $⇒$2NaOH $+$H_2 $↑
となります。
できた$2NaOH $は強塩基(強アルカリ)ですね。
$2Na $+$2H^{+} $⇒$2Na^{+} $+$H_2 $↑
イオン反応式の右辺にあった$2Na^{+} $と
$H_2O $⇔$H^{+} $+$OH^{ー} $
水が電離してできる$OH^{ー} $は反応します。
なので、これらをアルカリ金属というわけです。
ナトリウムやカリウムって周期表で言うと1族でアルカリ金属です。
そしてカルシウムはアルカリ土類金属です。
みんなアルカリとつきます。
どうしてでしょう?
水に溶けてアルカリ性を示すからです。
こういう共通の性質があるのです。
アルカリ性でなければアルカリ金属とかアルカリ土類金属とはいいません。
こんな感じでナトリウムなどは水に溶けて
強アルカリを生成します。
だから1族だとアルカリ金属、2族だとアルカリ土類金属というのです。
言われてみれば当然のことですね。
以上で解説を終わります。