今回の記事ではアルミニウムに希塩酸を加えたときの
化学反応式の作り方についてわかりやすく解説していきます。
Al(アルミニウム)に希塩酸(HCl)を加えたときの化学反応式の作り方
Al(アルミニウム)に希塩酸(HCl)を加えたときの化学反応式を作るのは
以前解説した3つの記事を理解できていればすごく簡単ですよ。
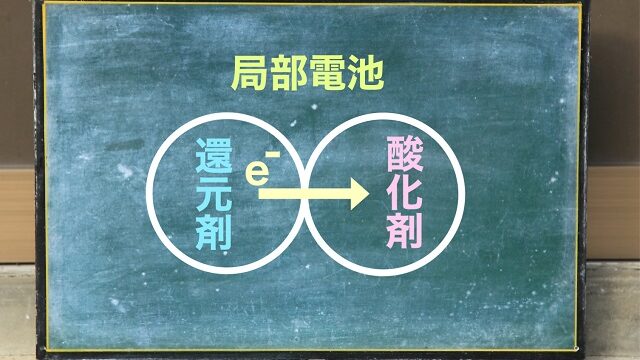
酸化還元反応式の作り方についてわかりやすく解説
・イオン化傾向が大きいほど何がいえるか?
・アルカリ金属が水と反応しやすいのはなぜ?わかりやすく解説
係数がちょっと難しいだけです。
アルミニウムは3価です。
価電子が3つあります。
なのでアルミニウムイオンは$Al^{3+} $です。
なのでその辺はちゃんと考えないと試験本番で係数を間違えてしまって
不合格になってしまう可能性があります。
気をつけてください。
ただ気をつけるのは係数くらいです。
まず以前の記事で解説した通り、イオン反応式から作りましょう。
⇒アルカリ金属が水と反応しやすいのはなぜ?わかりやすく解説
$2Al $(アルミニウム)+$6H^{+} $(希塩酸)⇒$2Al^{3+} $+$3H_2 $↑
希塩酸は酸だからイオン反応式だと水素イオン($6H^{+} $)になります。
この辺は以前解説したイオン化傾向がわかっていれば理解できるはずです。
イオン化傾向はAl>H
ですからね。
⇒イオン化傾向が大きいほど何がいえるか?
プロペラ軸受のロープガードです。
学生時代、海技試験の勉強では実物も見ずに丸暗記でした。本船では保護アルミをつけてます。
イオン化傾向の大きなアルミが先に溶けることで船体の腐食を防止します。『リッチに貸そうかな、まあ当てにすんな、酷すぎる借金』
皆さん覚えているでしょうか? pic.twitter.com/PO03bFd4lr
— 【公式】プリンセスわかさ (@Cosmo_Ichimaru) March 6, 2023
係数を合わせるの、難しいですか?
係数を合わせるのが難しいと思ったら、
酸化剤と還元剤を思い出してください。
⇒酸化剤と還元剤語呂を使った覚え方
水素イオンが電子をもらって水素ガスになるから以下のような半反応式ができますね。
⇒半反応式の問題を解きながら作り方も覚えよう!
それからアルミニウムの方は価電子が3つありますから
アルミニウムイオンというのは価電子を3つ失って$Al^{3+} $になりますね。
$2H^{+} $(水素イオン)+$2e^{ー} $⇒$H_2 $↑
$Al $⇒$Al^{3+} $++$3e^{ー} $
上記半反応式を見てください。
水素の方は電子が$2e^{ー} $なので2個、
アルミニウムの方は電子が$3e^{ー} $なので3個存在しますね。
ということはお互い電子が6個ずつであれば
電子を消すことができますよね。
よって
$2H^{+} $(水素イオン)+$2e^{ー} $⇒$H_2 $↑
$Al $⇒$Al^{3+} $++$3e^{ー} $
において、水素を3倍、アルミニウムを2倍にして
$6H^{+} $(水素イオン)+$6e^{ー} $⇒$3H_2 $↑
$2Al $⇒$2Al^{3+} $++$6e^{ー} $
となり、水素とアルミニウムを足せば
$6H^{+} $(水素イオン)+$6e^{ー} $+$2Al $⇒$3H_2 $↑+$2Al^{3+} $+$6e^{ー} $
となって中学校で習う方程式と同じように
両辺の$6e^{ー} $は同じ数なので消えますから、
$6H^{+} $(水素イオン)+$2Al $⇒$3H_2 $↑+$2Al^{3+} $
となって、先ほどのイオン反応式と同じになりましたね。
化学が得意な人であればいきなりイオン反応式を
$2Al $(アルミニウム)+$6H^{+} $(希塩酸)⇒$2Al^{3+} $+$3H_2 $↑
と書いても良いでしょう。
でも慣れてない人であれば酸化剤、還元剤、イオン化傾向の知識を応用して
半反応式から書いていけばよいでしょう。
$6H^{+} $(水素イオン)+$6e^{ー} $⇒$3H_2 $↑
$2Al $⇒$2Al^{3+} $++$6e^{ー} $
詳しい流れはこちらで書いていますので
読んでいただければ理解できると思います。
⇒酸化還元反応式の作り方についてわかりやすく解説
話を元に戻します。
今回は(希)塩酸ですからイオン反応式の両辺に塩化物イオン$Cl^{ー} $を
両辺に6個加えればよいわけです。
$2Al $(アルミニウム)+$6H^{+} $(希塩酸)⇒$2Al^{3+} $+$3H_2 $↑
なので、
$2Al $+$6HCl $(希塩酸)⇒$2AlCl_3 $+$3H_2 $↑
となるわけですね。
私が獣医学部に入るために化学の勉強をしていました。
⇒プロフィールと当ブログを作ることになったきっかけ
化学で一番面白いと思うことっていっぱいありますが、
化学反応式を組み立てていくのってすごく面白いと感じます。
どうしてかというと
自分が知らないような化学反応式でも
酸化剤、還元剤、イオン化傾向の知識があれば
きちんと組み立てることができるからです。
以上で解説を終わります。