配位結合とはどんな結合なのでしょうか?
説明だけだと分かりにくいと思ったので、
例を挙げながら中学生でもわかるようにわかりやすく解説します。
配位結合とは?わかりやすく説明します
配位結合とはちょっと特殊な共有結合の一種です。
共有結合については以前、詳しく解説したのでこちらをご覧ください。
⇒共有結合とは?簡単に例を挙げながら解説します
配位結合とは何か?
$H_2O $(水)を例に考えると
非共有電子対を$H^+ $に押し付けて2個とも押し付けてできる結合のことです。

非共有電子対というのは電子対の中でも、
他の原子と共有していないもののことです。
非共有電子対はすごく安定な状態です。
詳しくは共有結合のところで解説しているので気になる方はこちらをご覧ください。
⇒共有結合とは?簡単に例を挙げながら解説します
配位結合の例を挙げてみた方が分かりやすいと思うので
例を挙げてみますね。
アンモニアを例にします。
アンモニア($NH_3 $)の電子式はこうなりますね。
⇒電子式書き方の決まりをわかりやすく解説
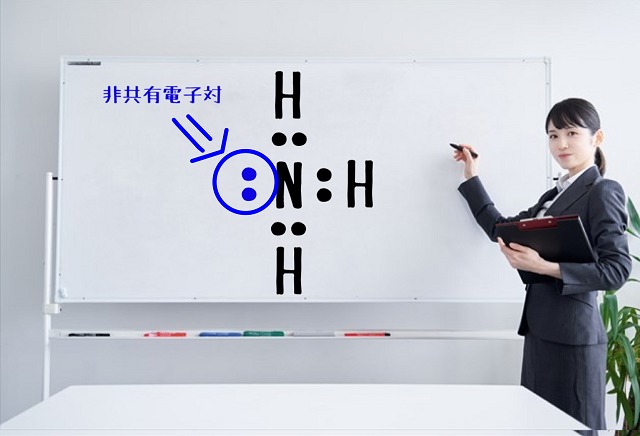
上記図を見てください。
非共有電子対がありますね。
この非共有電子対が2個とも水素イオン($H^+ $)に対して
押し付けて結合が作られるのが配位結合です。
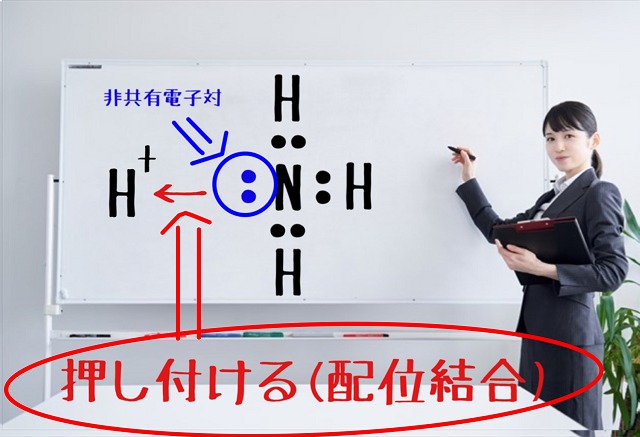
要するに水素イオンとアンモニアが出し合っているのではないというのが最大のポイントです。
出し合っているのではなくて、アンモニアの非共有電子対が水素イオンに向かって押し付ける形で
結合するのが配位結合です。
お互い出し合っているのではなくて
一方的に電子対の形で提供してできる結合を配位結合といいます。
今回の場合にはアンモニウムイオンが出来上がりました。
配位結合の他の例として$H_2O $(水)があります。
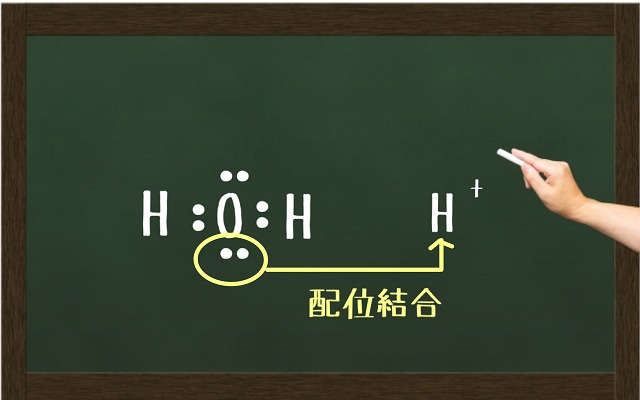
水だったら、こちらの図のように配位結合します。
結果、$H_3O^+ $(オキソニウムイオン)が完成します。
配位結合という名前を聞くと「???」となってしまいますね。
しかも、イオンが出てくるから共有結合っぽくありません。
でも、結合を作った後は、普通の共有結合とはなんら区別ができなくなります。
だから配位結合は共有結合の1つだということになります。
以上で配位結合についての解説を終わります。