前回は共有結合について解説しました。
⇒共有結合とは?簡単に例を挙げながら解説します
共有結合とイオン結合はまったく違うのですが、
でも、素人目に共有結合とイオン結合が似ていて
違いがよくわからないという方も多いです。
そこで今回はイオン結合とはどういう結合なのか、
簡単にわかりやすく解説したいと思います。
今回のイオン結合の記事を読んでいただいた後、
共有結合の記事を読めば、おのずと共有結合とイオン結合の違いが
よくわかるようになると思います。
⇒共有結合とは?簡単に例を挙げながら解説します
Contents
イオン結合とは?
まず、イオン結合とはどんな結合なのか、
直観的に理解するために具体例を挙げてみたいと思います。
$Na $(ナトリウム)ですが、
ナトリウムプラスという陽イオンに変わります。
学問的には$Na^{+} $と表記します。
このことをイオン化といいます。
電気的なバランスが崩れてまででも
最外殻を満タンにしたいということで起こる現象がイオン化です。
電気的なバランスとか最外殻の話が謎な方はこちらをご覧ください。
⇒最外殻電子とイオンの関係をわかりやすく解説
話を元に戻して$Cl $(塩素)ですが、
$Cl^{-} $という陰イオンに変わります。
ここまでは以前の記事の復習ですからね。
⇒最外殻電子とイオンの関係をわかりやすく解説
ここで$Na^{+} $のプラスと$Cl^{-} $というマイナスが電気的に
引き寄せあって結びつきます。

これは磁石なんかを想像するとわかりますね。
プラスとマイナスってお互い惹きつけあう関係なんです。
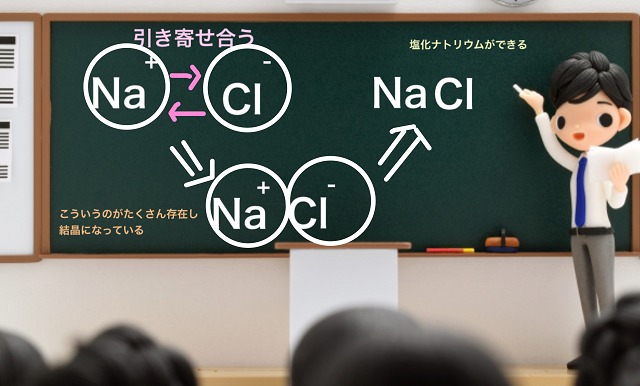
とにかく$Na^{+} $のプラスと$Cl^{-} $というマイナスが電気的に
引き寄せあって結びついた結果、$NaCl $(塩化ナトリウム)という物質になります。

こういうのがプラスとマイナスが規則正しくいっぱい並んで存在しています。
このようにできたものをイオン結合の結晶といいます。
ちなみに塩化ナトリウムは食塩になります。
食事のときに味が薄い場合、食卓塩を振りかけますね。
あの塩は化学的には塩化ナトリウムといいます。

$Na^{+} $や$Cl^{-} $はイオン化していて、
$Na^{+} $はプラスの電気を$Cl^{-} $はマイナスの電気を持っています。

プラスとマイナスの電気は結びつくという性質があるので
電気的に結びついて固まった上記図のようなものをイオン結合の結晶といいます。
ところで電気的に結びつくという性質を静電気力(静電気引力あるいはクーロン力とも)といいます。
別の表現をすると静電気力(静電気引力あるいはクーロン力とも)とはイオン化した原子($Na^{+} $)と原子($Cl^{-} $)との間に働く力のことです。
大学受験の化学だと静電気力というよりクーロン力という用語で
出題されることが多い気がします。
イオン結合の性質
このようにイオン同士がくっついてできたイオン結合性質って
どんな感じなのでしょうか?
結合力はイオン結合はすごく強いです。
結合力が強いということは融点が高いということもできますね。
融点とは氷などの固体から水などの液体に変わるときの温度のことです。
化学的には融点とは固体から液体に変化するときの結合が切られる温度のことです。
結合が強いということはお互い切れにくいわけです。
固体から液体にそう簡単にならないため、
融点は高くなります。
ナトリウムと塩素の関係で説明しますね。
ナトリウムと塩素がピタッと結合しているわけですね。
これが結合力です。

結合力が強いというのはどういうことでしょう?
バーナーであぶっている状態を想像してください。
これくらい強い火であぶられてもイオン結合をしている塩素とナトリウムは
そう簡単には離れません。
イオン結合は強い結合だからです。
火あぶりにしても結合力が強く離れないから
形を維持します。
でも、離れたら形が維持できません。
形が維持できない状態が固体が液体になるタイミングで融点に該当します。
なので、イオン結合は結合力が強いため融点も高くなります。
もちろん、融点同様、沸点(液体が期待に変わる温度)も同じ理屈から高くなります。
つまり、結合力と融点、沸点は密接なつながりがあるということです。

また、結合力が強ければハンマーや金づちで叩いても
そう簡単に結合を外せません。
これは大きな目で見たらイオン結合は硬いということです。
でも、イオン結合は『もろい』です。
『もろい』というのはイオン結合の特徴なので覚えておきましょう。

先ほども示しましたが、上記図のようにイオン結合というのは
プラスとマイナスのものが規則正しく交互に配列しています。

これに対してハンマーで強い衝撃を与えてみると、
配列がずれてしまい、プラスの下にプラス、マイナスの下にマイナスがきたりして
同じ電気が並んでしまいます。

プラスとマイナスならくっつきますが、プラスとプラス、
マイナスとマイナスだったら反発してしまい離れます。
この反発するというのが『もろい』という状態になります。
この『もろい』という現象はイオン結合特有ですので
よく覚えておいてくださいね。
また、オキシクリーンなどの化学物質を使う方は
こういう現象を理解しておくと、
いろんな場面で応用が利くので知っておいてください。
あと、イオン結合は結晶の状態(固体の状態ということ)では電気伝導性はありません。
でも、溶けたり水溶液中であれば電気伝導性が発生します。

なぜなら固体の状態(結晶の状態)だとプラスとマイナスときちっと配列されているため、
電気が移動できるだけの隙間がないからです。
でも、溶けた状態だとプラスとマイナスに隙間ができるため、
電気が自由に行き来できるようになるため、電気が伝わるようになります。
この場合、水溶液中に電極を挿して
電球を置いたら、ピカッと光ります。
これでイオン結合の解説を終わりますが、
結合はこれだけではありません。
他にもいろいろあります。
次は共有結合をご覧ください。
イオン結合との違いが分かると思います。
⇒共有結合とは?簡単に例を挙げながら解説します
あとイオン結晶の記事も書きました。
⇒イオン結晶の特徴をわかりやすく解説















